
Неорганическая химия / Астахов М.В. Теория химической связи
.pdf
Можно показать, что в применении к чисто вращательным спектрам двухатомных молекул частное правило отбора приобретает вид J = ± 1. Разность энергии двух последовательных уровней равна
Евр = В0ħ {(J'(J' + 1) - J"(J" + 1)}. |
(17) |
Здесь J΄ относится к верхнему вращательному состоянию, a J" - к низшему. Поскольку частное правило отбора требует, чтобы J΄ — J" = 1, то
Евр = В0ħ 2J΄ |
(18) |
Из этого уравнении получены разности уровней энергии, приведенные в таблице 3. Хотя расстояние между уровнями энергии линейно растет с J, спектр будет состоять из ряда полос, равно отстоящих друг от друга, как это показано на рис. 6. Поскольку v = E/h, частотный интервал равен
Δυ=2В0 |
(19) |
Таблица 3. Чисто вращательные уровни жесткого ротатора в инфракрасном спектре
Таким образом, из интервалов спектра можно найти момент инерции непосредственно по уравнению (16) и, зная массы атомов, из уравнения (14) получить единственный параметр молекулы r0.
В качестве иллюстрации использования приближения жесткого ротатора можно рассмотреть спектр молекулы HI в далекой инфракрасной области. Обнаружено, что вращательный спектр состоит из ряда линий с интервалом Δν= 12,8 см-1. Отсюда истинная частота вращения равна
v = с/λ = (3,00 • 1010) (12,8) = 3.84•1011 1/сек.
Разность энергии двух последовательных уровней составляет h v = (6,62 10-27)(3,84 1011) = 2,54•10 -15 эрг
При детальном исследовании линий чисто вращательного спектра оказывается, что в действительности интервалы между линиями уменьшаются с ростом J. Такое поведение можно объяснить тем, что на более высоких ротационных уровнях молекула вращается быстрее и вследствие центробежной силы связь несколько растягивается. При этом возрастает момент инерции и, следовательно, уменьшаются частотные интервалы.
21
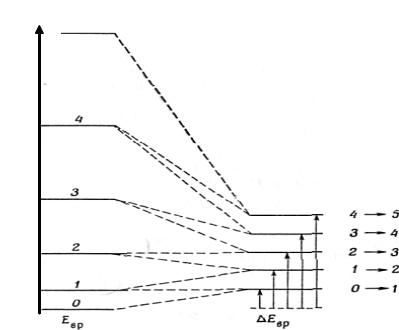
Оказалось, что правильно описать уровни энергии можно, введя поправочный член, и
тогда
Eвр = B0hJ (J +1) − D0h{J (J +1)}2 |
(20) |
Константа D0 называется постоянной центробежного искажения и составляет приблизительно 10-4 В0.
J 5
Рис. 6. Чисто вращательный спектр двухатомной гетероядерной молекулы.
При небольших значениях J второй член пренебрежимо мал. И постоянная центробежного искажения в основном колебательном состоянии, и химическая теплота диссоциации обозначаются одним и тем же символом D0, но возникновение недоразумении здесь маловероятно.
Формулы, выведенные для уровней энергии, применимы также и к линейным многоатомным молекулам. Работа в далекой инфракрасной области спектра очень затруднительна, и предпочтительнее исследовать чисто вращательные спектры в микроволновой области. Микроволновая спектроскопия — очень удобное орудие исследования, так как она позволяет определить величины дипольных моментов молекулы, ядерных спинов и моментов, квадрупольных моментов. Сейчас, однако, эти величины не рассматриваются. Для наших целей между микроволновой спектроскопией и спектроскопией в далеко инфракрасной области нет почти никакой разницы. Кроме того, чтобы получить практически монохроматический пучок микроволн гораздо легче. Поэтому в микроволновой спектроскопии можно достигнуть гораздо более высокого разрешения, и это позволяет находить очень точные значения вращательных постоянных и молекулярных параметров.
22
2. Гетерополярная связь в молекулах
Одно из первых наиболее простых объяснений образования молекул из атомов было взаимодействие двух заряженных частичек катион-анион. Такая модель была доведена до численного расчета.
В квантовой механике, исходя из идей Бора, можно найти энергию связи электрона с ядром в водороподобных атомах. Знание энергии связи электрона с ядром позволяет рассчитать энергию кванта, необходимую для отрыва электрона от любого атома. Эту энергию называют энергией ионизации атома. Но, отрывая валентные электроны, которые находятся на внешней оболочке, мы можем добиться, что останутся только электроны на первой полностью заполненной оболочке. Как, например, у атома натрия.
Naгаз→ Na+ + e- – I |
(21) |
Но электроны, которые покинули этот атом, должны куда-то деться. Их принимает другой атом, которому не хватает их до построения у себя завершенной электронной оболочки. Эту работу, точнее энергию, выделяемую при образовании отрицательной частицы (аниона) из атома и электрона, называют сродством к электрону данного атома.
Cl + e- → Cl- + А |
(22) |
Понятно, что энергия ионизации и сродство к электрону для каждого атома являются величиными постоянными, характерными только для данного атома. Эти величины имеют разные знаки. В первом случае мы затрачиваем энергию для отрыва электрона во втором выигрываем.
2.1Электроотрицательность.
Влюбой молекуле при ее образовании, в соответствие с этой моделью, один атом будет отдавать, а другой присоединять электроны. Кто будет иметь знак плюс, а кто минус, можно оценить, сравнивая эти энергии. С этой целью вводят понятие электроотрицательности атома, которое является алгебраической суммой этих двух величин.
I +Q=J |
(23) |
Поскольку об устойчивости системы мы можем судить по уменьшению энергии, к которому будет приводить та или иная структура, то вопрос «кто есть кто?» в молекуле решается достаточно просто. Рассмотрим два процесса, в результате которых образуются две одинаковые молекулы.
A+B→A+B- |
A+B→A-B+ |
(24) |
IA – QB=E(A+B-) |
IB – QA =E(A-B+) |
(25) |
E(A+B-)< E(A-B+) |
(26) |
|
IA –QB < IB – QA |
(27) |
|
IA + QA=JA < IB + QB=JB |
(28) |
|
JA < JB |
(29) |
|
23
где JA, JB электроотрицательность атомов А и В, т.е. электроотрицательность по оп-
ределению равна алгебраической сумме потенциала ионизации данного атома и его сродства к электрону.
Понятно, что важны не сами значения, а тенденция, т.е. для решения этого вопроса удобнее брать относительные, а не абсолютные величины. Лайнус Полинг ввел свою шкалу электроотрицательности (х), приняв за единицу электроотрицательность лития. И тогда можно, сравнивая просто числа, решить вопрос: кто анион, а кто катион в этой молекуле.
xi = |
Ji |
(30) |
|
J Li |
|||
|
|
Электроотрицательность всех атомов приведена в приложение 1.
2.2 Энергия образования гетерополярных молекул.
Но это опять качественная картина. Для того чтобы найти энергию образования, помимо знания, сколько энергии затрачено на ионизацию одного атома и сколько выделилось энергии при присоединении электрона к другому, надо рассчитать энергию, выделившуюся при взаимодействии двух разноименно заряженных частиц. Энергию электростатического взаимодействия рассчитать просто, исходя из закона Кулона:
E = − |
e2 |
(31а) |
|
ε0 r |
|||
1 |
|
где ε0 - диэлектрическая проницаемость вакуума, равная 8,85 10-12 Ф/м, е - заряд электрона, равный 1,6 10-19 Кл
r – расстояние между ядрами атомов, образующих молекулу.
В теории химической связи, как и в квантовой механике, очень часто используют не систему единиц СИ, а СГСЕ, в которой диэлектрическая проницаемость вакуума равна единице. Тогда уравнение (31) можно будет переписать следующим образом:
E = − |
e2 |
(31б) |
|
||
1 |
r |
|
|
|
Но это только энергия притяжения между атомами, но должна быть и энергия отталкивание, обусловленное взаимодействием электронов, которые имеются у каждого атома
E2 = Ae−α r |
(32) |
здесь А и α – константы.
Можно использовать и другую зависимость энергии отталкивания атомов от расстояния (r)
E |
2 |
= |
B |
(33) |
|
rn |
|||||
|
|
|
где, как и в предыдущем случае, B и n константы.
24
Использование той или иной зависимости приводят приблизительно к одним и тем же значениям энергии взаимодействия, так для NaCl разница всего лишь несколько килокалорий.
Полная энергия взаимодействия ионов будет равна:
E = − |
e2 |
+ |
B |
(34) |
|
r |
rn |
||||
|
|
|
Минимум энергии будет соответствовать равновесному расстоянию (r0) между ионами в молекуле, т.е.
dE |
|
= 0 = |
e2 |
− |
nB |
(35) |
|
|
|
|
|
|
|||
|
r |
rn+1 |
|||||
|
dr |
r =r |
|
|
|
||
|
|
|
0 |
|
0 |
|
|
|
|
0 |
|
|
|
|
|
Откуда можно найти константу В, которая будет равна:
B = |
e2rn−1 |
(36) |
|
0 |
|||
n |
|||
|
|
Подставляя это выражение в уравнение 4, получим:
E = − |
e2 |
+ |
B |
= − |
e2 |
(1− |
1 |
) |
(37) |
|
r |
rn |
r |
n |
|||||||
|
|
|
|
|
|
|||||
|
o |
|
o |
|
o |
|
|
|
|
Вторую константу n можно найти из следующих соображений: частота колебаний атомов в молекуле связана с константой жесткости связи, которая равна второй производной от энергии связи, как и в случае простого гармонического осциллятора.
ν = |
k |
(38) |
|
μ |
|||
|
|
здесь k- константа жесткости связи, а
μ приведенная масса колеблющихся атомов в двухатомной гетероатомной молекуле
|
|
|
|
|
μ |
= |
|
m1m2 |
|
|
(39) |
||||
|
|
|
|
|
m + m |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
2 |
E |
|
|
|
2e |
2 |
|
|
n(n +1)B |
|
|||
d |
|
|
|
|
|
|
|
|
|||||||
k = |
|
|
|
2 |
|
= − |
|
3 |
+ |
|
|
|
(40) |
||
dr |
r |
|
r |
n+2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Подставляя выражение для В из уравнения (36), т.е. беря производную в точке r=r0, получим
n =1+ |
r3k |
(41) |
|
0 |
|||
e2 |
|||
|
|
Энергию образования гетерополярной молекулы можно найти как сумму энергий:
E |
= I |
A |
−Q − |
e2 |
(1 |
− |
e2 |
) |
(42) |
|
r |
e2 + r3k |
|||||||||
обр |
|
B |
|
|
|
|
||||
|
|
|
|
|
|
|
0 |
|
|
25
2.3 Ионная связь в кристалле
Важнейшей особенностью ионной связи является ее ненасыщаемость и ненаправленность. Поле, создаваемое ионом, имеет сферическую симметрию, и все находящиеся в этом поле другие ионы испытывают его действие.
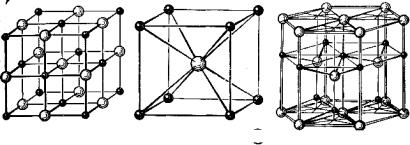
●Na ○Сl ●Cs ○Cl ● Zn ○O
Рис. 7. Решетки структурных типов NаСl, СsСl и ZnО
В результате ионы в кристалле образуют трехмерную бесконечную решетку, в узлах которой правильно чередуются катионы и анионы. Отдельных молекул в решетках солей типа КСl нет.
Кристаллическую решетку можно рассматривать как бесконечное повторение минимального трехмерного участка (параллелепипеда), называемого элементарной ячейкой. В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из кристаллических систем (сингоний): кубической, тетрагональной, гексагональной, тригональной, орторомбичеекой, моноклинной и триклинной (в порядке убывания симметрии). Ненасыщаемость и ненаправленность ионной связи приводят в большинстве ионных кристаллов к образованию структур так называемых плотнейших упаковок. Это кубические решетки типов NаСl и СsСl (рис. 7), сфалерита (ZnS) и флюорита (СаF2), гексагональные типа ZnО и др.
Важной характеристикой структурного типа кристалла является координационное число (КЧ); для ионных кристаллов это число ионов противоположного знака, окружающих данный ион: для NаС1 КЧ (Nа+)=КЧ(Сl-) =6, для СsС1 КЧ(Сs+) =КЧ(С1-) = 8, для флюорита КЧ(Са2+) = 8, КЧ(F-) =4. Расстояние между двумя ионами в кристалле можно условно разделить на две части и назвать их радиусами катиона и аниона. Приняв для радиусов ионов фтора и кислорода на основе физических представлений значения r(F-)=1,3310-10 и r(О2- )=1,32·10-10 м, Гольдшмидт по измеренным межъядерным расстояниям вычислил радиусы остальных ионов, исходя из принципа аддитивности: rк + rА =R, некоторые из которых приведены в таблице 4. Используются и другие системы радиусов ионов — Полинга, Белова и Бокия и др. Все эти радиусы следует рассматривать как эффективные величины, удобные для расчета расстояния в кристаллах.
26
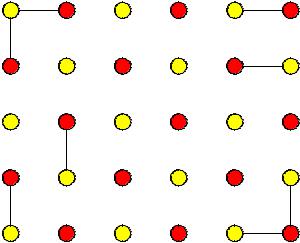
Таблица 4. Кристаллохимические радиусы некоторых ионов для КЧ=6
Ион |
Радиус 1010, м |
Ион |
Радиус 1010, м |
Ион |
Радиус 1010, м |
Ион |
Радиус 1010, м |
|
|
|
|
|
|
|
|
Li+ |
0,78 |
Ве2+ |
0,34 |
|
|
|
|
Na+ |
0,98 |
Мg2+ |
0,78 |
F- |
1,33 |
O2- |
1,32 |
К+ |
1,33 |
Са2+ |
1,06 |
Cl- |
1,81 |
S2- |
1 74 |
Rb+ |
1,49 |
Sr2+ |
1,27 |
Вr- |
1,96 |
Sе2- |
1 91 |
Сs+ |
1,65 |
Ва2+ |
1,43 |
I- |
2,20 |
Те2- |
2,11 |
Радиусы всех атомов и ионов приведены в приложениях 2 и 3.
Теория ионных кристаллов исходит из того, что в решетке существуют дальнодействующие электростатические силы притяжения между разноименными ионами и отталкивания между одноименными. Любой рассматриваемый ион в решетке непосредственно окружен противоионами, а ионы с таким же зарядом, расположены за ними, такое чередование сохраняется во всей решетке. Поэтому энергия кулоновского притяжения разноименных ионов преобладает над кулоновским отталкиванием. Надо учитывать также квантовомеханическое отталкивание ионов. Однако вклад такого отталкивания невелик, как и вклады от других сил взаимодействия, о которых будет сказано далее. Максимально устойчивой, равновесной структуре кристаллической решетки отвечает минимум энергии. Им же определяется и равновесное расстояние между ионами.
Энергией кристаллической решетки называется энергия, которая выделяется при образовании кристалла из газообразных ионов.
Различные физические свойства кристалла зависят от устойчивости его решетки. Мерой устойчивости считают изменение энергии в процессе распада 1 моля кристалла при температуре 0К на бесконечно удаленные ионы в основном состоянии. Эту величину называют энергией ионной кристаллической решетки (Uреш.).
Уравнение для расчета энергии ионной решетки было выведено Борном и Майером (1932), исходя из соотношения для энергии пары катион – анион. Наиболее просто уравнение для расчета энергии электростатического взаимодействия ионов можно показать на примере модели двумерной решетки ионного кристалла, представленной на рисунке 8.
Рис.8 Схема двумерной кристаллической решетки ионного кристалла.
27
Для любого однозарядового иона можно рассчитать энергию его электростатического взаимодействия со всеми другими ионами, исходя из простых геометрических соображений:
εкул = − |
e2 |
4 + |
e2 4 |
− |
e2 |
6 |
+ = − |
e2 |
(4 |
− |
4 |
+ |
6 |
− ) = − |
Аe2 |
(43) |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
r |
r 2 |
r |
5 |
r |
2 |
5 |
r |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
здесь r-расстояние между ионами с противоположным знаком. А- постоянная величина, равная сумме знакопеременного ряда.
Для трехмерного ионного кристалла это уравнение будет отличаться только множителями для расчета величины кулоновского взаимодействия, как следует из рисунка 9.
εкул =−e2 |
6+e2 |
12 |
−e2 |
8 |
+ =−e2 |
(6− |
12 |
+ |
8 |
− ) =−ae2 |
(44) |
|
2 |
3 |
2 |
3 |
|||||||||
r |
r |
r |
r |
|
|
r |
|
Рис. 9 Схема трехмерного ионного кристалла.
Уравнение 44 учитывает только энергию взаимодействия одного иона со всеми другими ионами кристалла. Аналогичное уравнение можно написать для любого иона, тогда для расчета энергии электростатического взаимодействия всех ионов в кристалле это значение необходимо помножить на общее число ионов. Для кристалла, содержащего по одному грамм-иону каждого типа, получим:
EΣ =εкулNA = −a |
N |
A |
e2 |
(45) |
|
r |
|||
|
|
|
||
где а – как и в предыдущем случае, постоянная величина, равная сумме знакопеременного ряда.
Эту постоянную называют постоянной Маделунга, для данного структурного типа кристалла, поскольку ее значение зависит от типа кристалла.
Таблица 5. Значения коэффициента а для некоторых структурных типов кристаллов
Структурный |
NaС1 |
СsС1 |
ZnS |
СаF2 |
TiO2 |
CdI2 |
А12О3 |
|
тип |
(сфалерит) |
(рутил) |
(корунд) |
|||||
|
|
|
|
|||||
а |
1,75 |
1,76 |
1,64 |
2,52 |
2,40 |
2,36 |
4,17 |
U = − |
aN |
|
e2 |
B |
|
|
A |
+ |
|
(46) |
|
|
rn |
||||
|
r |
|
|
||
Из уравнения 46 понятно, что постоянные B и n больше нуля.
28

Как и в случае гетерополярной молекулы (35), минимум энергии будет соответство-
вать равновесному расстоянию (r0) между ионами в кристалле, т.е.
|
∂U |
|
aN |
|
e2 |
nB |
|
( |
|
)r = |
|
A |
− |
|
= 0 |
∂r |
|
rn+1 |
|||||
|
0 |
r2 |
|
|
|||
|
|
|
0 |
|
0 |
|
|
Отсюда найдем коэффициент B
B = aNnAe2 r0n−1
|
aN |
|
e2 |
aN |
A |
e2 |
− |
U = − |
|
A |
+ |
|
|
rn 1 |
|
|
nrn |
||||||
|
r |
|
0 |
||||
|
|
0 |
|
|
0 |
|
|
U = − aNAe2 (1− 1) r0 n
(47)
(48)
(49а)
(49б)
Численное значение постоянной n может быть найдено из данных о сжимаемости кристалла. Как известно из курса термодинамики, коэффициент сжимаемости (β) определяется выражением:
β = − |
1 |
( |
∂V |
) |
T |
( |
∂P |
) |
T |
= − |
1 |
(50) |
V |
|
|
βV |
|||||||||
|
|
∂P |
|
∂V |
|
|
||||||
где V- мольный объем Р- давление.
Частная производная энергии Гельмгольца по мольному объему равна давлению
|
|
P = −( |
∂A |
) |
T |
|
|
(51) |
|||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
∂V |
|
|
|
|
||||
Используя известное уравнение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A=U-TS |
|
|
|
(52) |
|||||||
при Т→0, получим A=U |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P = −( |
∂U |
) |
T =0 |
(53а) |
|||||||||
|
|
||||||||||||||
|
|
|
|
|
|
∂V |
|
||||||||
− |
1 |
|
= −(∂2U ) |
T =0 |
(53б) |
||||||||||
βV |
|||||||||||||||
|
|
|
∂V 2 |
|
|||||||||||
β = |
|
1 |
|
|
1 |
|
|
|
|
|
(53в) |
||||
V (∂2U ) /(∂V 2 )T =0 |
|||||||||||||||
|
|
||||||||||||||
Объем одного моля кристалла может быть найден из уравнения |
|
||||||||||||||
|
|
V=NAr3α |
(54) |
||||||||||||
где NA- число Авогардо, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r- расстояние между ионами противоположного знака, |
|
||||||||||||||
29

α - коэффициент формы.
Тогда коэффициент сжимаемости кристалла можно будет найти путем простых математических преобразований:
dV=NAα3r2dr
dU = dU dr dV dr dV
Вторая производная внутренней энергии кристалла по объему будет равна
d 2U |
= (dU ) |
d 2r |
+ |
dr d 2U dr |
|||
|
|
|
|
|
|||
dV 2 |
dV 2 |
dV dV 2 dV |
|||||
dr |
|
||||||
(55)
(56)
(57а)
Учитывая, первая производная внутренней энергии по расстоянию в точке r=r0, как следует из уравнения (47), равна нулю, получим
|
(d2U )r |
= d2U |
( |
dr |
)2 |
|
|
|
|
(57б) |
||||||
|
|
|
|
|
|
|
||||||||||
|
dV2 |
|
0 |
|
dr2 |
|
dV |
|
|
|
|
|
||||
Дифференцируя дважды уравнение (46), получим |
|
|
|
|
|
|||||||||||
|
d 2U |
= −2 aNAe2 |
+ n(n +1)B |
|
(58а) |
|||||||||||
|
dr2 |
|
|
|
r3 |
|
|
|
rn+2 |
|
|
|
|
|||
Подставляя в это уравнение вместо коэффициента B его значения из (48): |
|
|||||||||||||||
d 2U |
|
aN |
|
e2 |
|
n(n |
+1) aN |
|
e2 |
− |
|
|||||
|
= −2 |
|
A |
|
+ |
|
|
|
|
|
|
|
A |
|
rn 1 |
(58б) |
dr2 |
|
|
|
rn+2 |
|
|
||||||||||
|
r3 |
|
|
|
n |
|
0 |
|
||||||||
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d 2U |
= aNAe2 |
(n −1) |
|
|
|
|
(59) |
||||||||
|
dr2 |
|
|
r3 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
В уравнение (57б), кроме второй производной внутренней энергии, входит в виде со-
множителя (dVdr )2 , который можно найти из уравнения (55)
( |
dr |
) = |
1 |
|
(n −1) |
( |
dr |
) |
2 |
= |
1 |
|
|
|
(60) |
dV |
3N αr |
2 |
dV |
|
2 |
2 |
r |
4 |
|||||||
|
|
|
|
|
|
|
|
9N α |
|
|
|
||||
|
|
|
A |
|
|
|
|
|
|
|
A |
|
0 |
|
|
Тогда уравнение (57) можно записать следующим образом:
(d 2U ) = aNAe2 |
(n −1) |
1 |
= |
ae2 |
(n −1) |
(61) |
|||
9α2 N 2r4 |
9α2 N |
r7 |
|||||||
dV 2 |
r3 |
|
|
|
|
||||
|
0 |
|
A 0 |
|
|
A 0 |
|
|
|
Подставляя его в уравнение (53в) с учетом выражения для мольного объема кристалла (54), получим:
β = |
|
1 9α2 N |
r7 |
= |
9αr4 |
(62) |
||
|
|
|
|
A 0 |
0 |
|||
N |
r3 |
|
ae2 (n |
−1) |
ae2 (n −1) |
|||
|
|
|
|
|||||
|
|
A 0 |
|
|
|
|
|
|
Откуда найдем n
30
