
Неорганическая химия / Астахов М.В. Теория химической связи
.pdfрыхляющая орбиталь ведет к уменьшению плотности заряда в этой области и к концентрации его около индивидуальных атомных ядер. Так как ковалентная связь возникает при распределении электронного заряда в области связи, то очевидно, что только симметричная функция обусловливает образование устойчивой молекулы.
МО позволяет оценить вклад в энергию химической связи не только электронных пар, но и отдельных электронов. При попадании электрона на связывающую орбиталь возникает связь ψ1мол, при попадании электрона на разрыхляющую орбиталь ψ2мол связь не возникает. Энергия взаимодействия атомов в молекуле увеличивается с ростом числа электронов на связывающих орбиталях. Увеличение числа электронов на разрыхляющих орбиталях приводит к уменьшению энергии взаимодействия атомов в молекуле. Если число электронов на связывающих орбиталях равно числу электронов на разрыхляющих, то молекула не образуется. Следует отметить, что при учете S12 картинка энергии связи становится не симметричной и переход электрона на ψ2мол увеличивает энергию больше, чем понижение энергии при переходе на ψ1мол, т.е.
|Е2-2Е0 |>|Е1-2Е0| . |
(179) |
Связывающие и разрыхляющие действия обусловлены видом волновых функций молекулярных орбиталей. При сложении атомных волновых функций ϕ1 и ϕ2 величина ψ1мол в пространстве между ядрами возрастает, т.е. появляется зона высокой электронной плотности, которая притягивает ядра и осуществляет химическую связь. При вычитании ϕ2 из ϕ1 электронная плотность между ядрами уменьшается, что усиливает их отталкивание.
Атомные орбитали могут перекрываться друг с другом, образуя σ и π-связи. Договоримся об обозначениях: МО из s-атомарных орбиталей называют σ-связями;
МО из рz-атомарных орбиталей - σz . Для двухатомных молекул принято считать, что ось z проходит через ядра атомов. МО π-орбитали, образованные из рx и рy атомных орбиталей, обозначаются πx и πy. Разрыхляющие орбитали принято отмечать звездочкой (πx*). Часто МО обозначают также, указывая после σ и π АО, из которых образовалась МО (σ1s, π2рx и
т.д.).
Вметоде МО гораздо проще, чем в методе ВС, учитывается делокализация электронов.
ВВС приходится применять сложное и не отвечающее реальной действительности построения молекулярных орбиталей. В МО сразу получается молекулярная орбиталь, охватывающая сразу несколько атомов. Это значительно упрощает расчеты.
Поэтому этот метод, в котором молекулярная орбиталь строится как алгебраическая сумма атомарных орбит электронов, нашел широкое распространение и получил название МО ЛКАО (метод молекулярных орбиталей в приближении линейной комбинации атомарных орбиталей). В этом методе обычно проводят расчеты для определенного из эксперимента расположения атомных ядер. Атомные ядра закрепляются в своих равновесных положениях и для такой системы находят молекулярные орбитали и их уровни энергии. Затем последовательно заселяют эти орбитали электронами с учетом принципа Паули.
Взаимодействием электронов в первом приближении можно пренебречь. Переход
электрона с ϕАО на ϕМО (связывающую) уменьшает энергию системы. Переход электрона с ϕАО на ϕМО (разрыхляющую) не происходит, т.к. энергия системы увеличивается. Таким образом, вопрос об устойчивости молекулы сводится к энергетическому балансу всех связы-
61
вающих и разрыхляющих электронов. Еще раз напоминаю, что один электрон на ψ*раз сводит на нет действия электрона на ψсв.
3.7 Применение метод молекулярных орбиталей для описания свойств гомеополярных и гетерополярных молекул.
Для гетероядерных двухатомных молекул коэффициенты ЛКАО в приближении МО ЛКАО нельзя найти на основании симметрии. Их определяют методом, основанным на вариационном принципе.
Предположим, что МО, представленные в приближении ЛКАО в виде
ψ = ∑сνϕν |
(180) |
ν |
|
являются собственными функциями некоторогогамильтониана Ĥ, т. е. |
|
Ĥψ = Еψ. |
(181) |
Здесь не рассматривается явный вид оператора Ĥ, следует отметить только, что он является одноэлектронным оператором (так как ψ — одноэлектронная функция), который, строго говоря, определяется однозначно лишь для молекулы с одним электроном (например, Н2+): в этом случае Ĥ есть фактический электронный гамильтониан молекулы. Ĥ содержит оператор кинетической энергии электрона и усредненный эффективный потенциал, действующий на выделенныйэлектрон и создаваемый всеми ядрами и остальными электронами молекулы.
Подставляя выражение (180) в уравнение (181), получаем
∑сν (Нˆ − Е)ϕν = 0 |
(182) |
ν |
|
Чтобы определить коэффициенты Сν, умножим выражение (182) слева на одну из АО, например φμ (или комплексно сопряженную с ней, если рассматриваются комплексные функции), и проинтегрируем по всему трехмерному пространству. Это дает
∑сν (Нˆ μν − Sμν Е) = 0 |
(183) |
ν |
|
где |
|
Нμν = ∫ϕμ Нˆϕν dv |
(184) |
Sμν = ∫ϕμϕν dv |
(185) |
Уравнение типа (183) выводится для каждой из АО, включаемых в линейную комбинацию (180). Если число таких орбиталей равно n, то получаем систему п уравнений относительно п коэффициентов сν. Определитель системы этих уравнений называют вековым (секулярным); эта система уравнений имеет ненулевое решение только в том случае, если вековой определитель порядка п равен нулю
|Hμν -SμνE| = 0. |
(186) |
62
Раскрывая определитель, получаем уравнение степени п относительно Е, которое имеет п корней. Решения этого уравнения есть энергии МО, которые могут быть образованы линейными комбинациями п АО.
Пусть Еr — одно из решений уравнения (186). Чтобы найти коэффициенты в МО φr, имеющей это значение энергии, подставляем Еr вместо Е в систему (183) и, решая ее обычным методом, находим отношение коэффициентов. Абсолютные величины коэффициентов определяются из условия нормировки.
Уравнения (183) имеют в точности такой же вид, как и уравнения, полученные в результате применения вариационного принципа к линейной комбинации атомных функций с неизвестными коэффициентами. Отсюда следует, что МО, найденные путем решения системы (183), являются наилучшими в смысле вариационного принципа, даже если в сумме (180) были взяты малое число слагаемых — слишком малое для того, чтобы считать ψ собственной функцией оператора Н.
В качестве примера расчета по методу МО, в котором используются полученные выше уравнения, рассмотрим молекулу LiH (гидрид лития). Произведем только грубую оценку встречающихся в расчете интегралов, однако это все же позволит нам выделить качественные особенности МО гетероядерных двухатомных молекул. Основному состоянию атома лития соответствует конфигурация (1s)2 2s; атом водорода содержит один электрон, находящийся па 1s-орбитали. Предположим, что связь возникает благодаря делокализации 2s-электрона лития и 1s-электрона водорода в молекуле LiH. В простейшем варианте метода МО эта делокализация вводится построением МО как линейных комбинаций функций 2sLiH и 1sн. Для того чтобы сделать функцию более гибкой, включим в нее также 2pσ-орбиталь атома лития 1‡). Будем предполагать, что 1s- орбиталь лития не участвует и образовании связи, так как она не перекрывается с водородной 1s-орбиталыо сколько-нибудь значительно. Это предположение означает, по существу, что задача о молекуле LiH рассматривается как двухэлектронная. Возьмем σ- МО в виде
Ψ=Сh φh+Сsφs+ Сpφp |
(187) |
где φh — водородная 1s-орбиталь; φs — 2s- и φp — 2р σ – орбитали лития. Каро и Олсен вычислили все необходимые интегралы с этими атомными функциями. Воспользуемся их результатами. При равновесном значении длины связи 1,6 Ǻ интегралы пере-
крывания равны 2§) |
|
Shh =Sss=Spp, Ssp=0, Shs=0,469, Shp=0,506 |
(188) |
Рассмотрим теперь интегралы, содержащие гамильтониан. Предположим сначала, что рассматривается молекула LiH+. Можно было бы утверждать в этом случае, что внешний электрон движется в поле, потенциал которого создается зарядом протона, равным +1, зарядом ядра атома лития, равным +3, и двумя 1s-электронами лития.
–––––––––
‡) Используем обозначение 2рσ для р-орбитали, ориентированной вдоль линии связи; это общепринятое обозначение позволяет устранить необходимость указывать выбор координатных осей.
§) Изменим знак использованной Каро и Олсеном 2s -функции для того, чтобы все интегралы перекрывания были положительны.
63
Пусть U (1s2) — потенциал поля, создаваемого 1s-электроном. Тогда для молекулы LiH+ одноэлектронный гамильтониан Н можно записать в виде
H = − |
1 |
2 |
− |
1 |
− |
3 |
+ 2U (1s2 ). |
(189) |
2 |
r |
r |
||||||
|
|
|
|
H |
|
Li |
|
|
Если теперь перейти к молекуле LiH, то нужно включить еще потенциал, создаваемый вторым внешним электроном. Однако, пока не найдена соответствующая МО, этот потенциал не известен. Поэтому необходимо провести последовательный циклический расчет, приняв сначала МО в некотором, весьма грубом приближении и вычисляя с ее помощью потенциал, создаваемый электроном на этой орбитали. Далее этот потенциал добавляют в гамильтониан (189) и находят соответствующие этому гамильтониану МО. Эти МО используют далее для получения более точного потенциала, и эту процедуру повторяют до тех пор, пока не будет достигнуто самосогласование: при таком расчете с потенциалом получатся орбитали, практически совпадающие с теми, с помощью которых был построен сам потенциал.
Теперь выполним для молекулы LiH то, что можно было бы назвать первым циклом в расчете по методу ССП. Допустим, что низшая МО (отличная от орбитали 1sLi), на которую будут помещены два внешних электрона, распределена поровну между атомами. и электронную плотность на этой орбитали представим в виде
1 |
ϕ2 |
+ |
1 |
ϕ2 |
+ |
1 |
ϕ2 |
(190) |
2 |
h |
|
4 |
s |
|
4 |
p |
|
Несомненно, что такая орбиталь не может быть близка к искомой, так как водород имеет большую электроотрицательность, чем литий. Но мы располагаем, по крайней мере, некоторым приближением для начала вычислений. Тогда гамильтониан равен
H = − |
1 |
2 |
− |
1 |
− |
3 |
+2U (1sLi2 + |
1 U (ϕh2 ) + |
1 U (ϕs2 ) + |
1 U (ϕp2 ) |
(191) |
|
2 |
rH |
rLi |
||||||||||
|
|
|
|
|
2 |
4 |
4 |
|
Рассмотрим, например, интеграл Нss. Он разбивается на несколько слагаемых. Одно из них, равное
∫ϕs [− |
1 |
|
2 |
3 |
2 |
|
|
2 |
|
|
− |
|
+ 2U (1sLi )ϕs dv , |
(192) |
|
|
r |
||||||
|
|
|
|
|
Li |
|
|
можно считать совпадающим с энергией 2s-орбитали атома лития. По данным спектроскопии, эта энергия составляет —0,198ат. ед. Оставшиеся члены содержат интегралы типа
∫ϕs ( |
1 |
)ϕs dv |
(193) |
r |
|||
|
H |
|
|
и 1**)
–––––––––
I) |
** Потенциал, создаваемый электроном, находящимся на орбитали φh равен |
64
∫ϕsV (ϕh2 )ϕs dv ≡ ∫∫ϕs (1)ϕh (2)( |
1 |
)ϕs (1)ϕh (2)dv1dv2 , |
(194) |
|
|||
|
r12 |
|
|
которые можно взять из работы Каро и Олсена. Следуя таким путем, находим значения интегралов, содержащих гамильтониан:
Нhh= -0,391, Нss= -0,226, Нрр= -0,177,
Нhs= -0,212, Hhp= -0,219, Нsp = 0 (в силу симметрии).
Уравнения для орбитальных коэффициентов молекулы имеютвид
ch (-0,391- E) +сs(-0,212-0,469E) +ср(-0,219-0,506E) = 0, сh (-0,212- 0,469Е)+cs (-0,226-E) =0,
ch(-0,219-0,506E) + ср(-0,177-E)=0 |
(195) |
|||
ипослеумноженияна—1 приходим кследующему вековомуопределителю: |
|
|||
0,391+ E |
0,212 +0,469E |
0,219 +0,506E |
|
|
0,212 +0,469E |
0,226 + E |
0 |
= 0 |
(196) |
0,219 +0,506E |
0 |
0,177 |
+ E |
|
Раскрывая определитель (196), получим уравнение |
|
|
||
0,524Е3 + 0,277Е2 + 0,0194Е - 0,00316 = 0, |
(197) |
|||
которое имеет три корня: |
|
|
|
|
Е1 = - 0,396; Е2 = -0,206; Е3 = 0,074.
Наименьший корень соответствует энергии низшей МО. Подставляя его в систему (195) и полагая для определенностиСh = 1. получим, чтоСs= 0,153, Ср = 0,087. Ненормированная низшая МО, таким образом, имеет вид
|
Ψ=φh + 0,153φs + 0,087φр. |
|
(198) |
Нормировочный множитель равен |
|
|
|
{ψ 2dv}−1/ 2 |
= {1 + 0,0234 + 0,0076 - 0,3065Shs |- 0, 1745hp}-1/2 |
= 0,890, |
(199) |
∫ |
|
|
|
иокончательно |
|
|
|
|
ψ = 0,890φh+ 0, 136φs+ 0,077φр. |
|
(200) |
Итак, в результате расчета получилось, что около 80% электронной плотности приходится на 1s-орбиталь, что довольно сильно отличается от величины 50%, принятой в исходной функции при построении гамильтониана (191). Чтобы улучшить результаты расчета, орбиталь (200) надо использовать для получения более точного потенциала в гамильтониане (191). Каро и Олсен в результате самосогласованного расчета получили следующие отношения коэффициентов:
Сs/Сh= 0,468, Сp/Сh = 0,292, |
(201) |
которые соответствуют орбитали
ψ=0,700φh+0,328φs+0,204φp |
(202) |
65
Взятое со знаком минус значение энергии, полученное при решении векового уравнения, можно приравнивать потенциалу ионизации электрона этой МО в предположении, что волновые функции остальных электронов при ионизации молекулы не изменяются. В нашем расчете потенциал ионизации молекулы LiH получается равным 10,8эв. Самосогласованные вычисления Каро и Олсена дают 8,3эв, что довольно хорошо согласуется с экспериментальным значением 8эв.
Коэффициенты ЛКАО в методе МО непосредственно определяют меру ионности связи. Например, расчет молекулы LiH убедительно показывает, что избыток электронного заряда имеется на атоме водорода. Этот результат согласуется с химическими свойствами молекулы.
Если волновая функция молекулы представлена в виде произведения МО, антисимметриэованного в соответствии с принципом Паули, то электронная плотность молекуле вычисляется следующим образом:
|
|
|
ρ = ∑nhψh2 |
|
|
|
(203 ) |
|
|
|
|
|
h |
|
|
|
|
где nh- число электронов, занимающих МО ψh (оно может быть равным 0,1,2). |
||||||||
Для молекулы LiH при вычислении коэффициентов С получаем |
|
|
||||||
ρ =2(1s |
)2 +0,98ϕ2 |
+0,22ϕ2 |
+0,08ϕ2 |
+0,92ϕ ϕ +0,57ϕ ϕ |
+0,27ϕϕ |
p |
(204) |
|
Li |
h |
s |
p |
h s |
h p |
s |
|
|
В этом выражении содержатся плотности, соответствующие АО, например, φh2, и плотности перекрывания, например, φh,φp. Чтобы выяснить, как распределяются электронный заряд между двумя атомами, предположим, что плотности перекрывания φh,φp равны полусумме плотностей, соответствующих орбиталей φh и φp, умноженной на интеграл перекрывания, для того чтобы сохранялся суммарный электронный заряд ††):
ϕ ϕ |
= |
Sab |
(ϕ2 |
+ϕ2 ) |
(205) |
|
|||||
a b |
|
2 |
a |
b |
|
|
|
|
|
|
Такая процедура позволяет получать величины, которые называются полными атомными заселенностями; сумма их равна полному числу электронов в молекуле. Для молекулы LiH получаются следующие значения заселенностей:
1sLi=2, 2sLi=0,432, 2pσLi=0,228, 1sh=1,340.
Отсюда следует, что связь в молекуле LiH имеет ионный характер, который можно выразить формулой Li+0,34H-0,34.
3.8 Молекулярные орбитали двухатомных молекул.
Теория молекулярные орбитали позволяет объяснить устойчивость различных молекул, используя представления о связывающих и разрыхляющих молекулярных орбиталей. В качестве примера разберем устойчивость двухатомных молекул первых двух периодов. Начнем с иона молекулы водорода (Н2+).
Н[1s] + Н+=Н2+ или Н[1s] + Н+= Н2+[σ1s]
–––––––––
†† )Суммарный заряд сохраняется, если обе части этого равенства проинтегрировать по всему пространству.
66
Н2 2Н[1s]=Н2 [(σ1s)2]
Не2+ Не[1s2] + Не+[1s1]=Н2+[(σ1s)2 (σ*1s)]
Эта запись означает, что при образовании такой молекулы образуется две σ-МО, одна связывающая (σ1s)2, другая разрыхляющая (σ*1s). На первой сидит пара электронов с разными спинами, а на второй один, первые два связывают атомы в молекулу, второй эту энергию связи уменьшает. Понятно, что Не2 не может существовать т.к. количество электронов на связывающих орбиталях будет равно количеству электронов на разрыхляющих.
Не[1s2] + Не[1s2]=Не2[(σ1s)2 (σ*1s)2]
Второй период.
Первый К – слой заполняется и не принимает участие в образовании связей в молекуле. Он является остовом, как в атомарном заполненном слое, и в структурном изображении молекул обозначается буквой К. Экспериментально установлено, что орбитали в молекулах второго периода заполняются в порядке возрастания энергии связи в следующем порядке:
σ1s <σ*1s<σ2s<σ*2s<σ2рz<π2рy=π2рх <π*2рy=π*2рх<σ*2рz
Энергия электронов на σ2рz π2рy=π2рх близки, и в некоторых молекулах соотношение между ними может быть другим π2рy=π2рх <σ2рz
Li2 |
2Li[К2s]= Li2[КК(σs)2] или Li2[КК(σ2s)2] |
Be2 |
2Be[К2s2]= Be2[КК(σs)2(σs*)2] |
такая молекула не может образоваться.
B2 2B[К2s2р1]=B2[КК(σs)2(σs*)2(πy)(πх)]
т.е. два электрона на двух энергетически одинаковых орбиталях в соответствие с правилом Гунда, что было подтверждено экспериментально.
C2 |
2C[К2s2р2]=C2[КК(σs)2(σs*)2(πy)(πх)( σ z)] |
N2 |
2N[К2s2р3]=N2 [КК(σs)2(σs*)2(πy)2(πх)2(σz)2] |
O2 |
2O[К2s2р4]=O2[КК(σs)2(σs*)2(σz)2(πy)2(πх)2(π*y)(π*х)] |
F2 |
2F[К2s2р5]=F2[КК(σs)2(σs*)2(σz)2(πy)2(πх)2(π*y)2(π*х)2] |
Ne2 |
2Ne[К2s2р6]=Ne2[КК(σs)2(σs*)2(σz)2(πy)2(πх)2(π*y)2(π*х)2(σ*z)2] |
В таблице 11 приведены энергии и связи двухатомных молекул. Как видно из этих данных, энергия связи между атомами в молекуле растет с ростом числа электронов на связывающих орбиталях, а длина связи уменьшается. Молекула азота, имеющая на связывающих орбиталях 6 электронов, является наиболее устойчивой по сравнению со всеми другими молекулами, образованных атомами второго периода.
Таблица 9. Характеристики двух атомных молекул, полученные методом МО.
Молекула |
Li2 |
Be2 |
B2 |
C2 |
N2 |
O2 |
F2 |
Ne2 |
Избыток связывающих электронов |
2 |
0 |
2 |
4 |
6 |
4 |
2 |
0 |
Есвяз (ккал/моль), |
23 |
0 |
69 |
114 |
225 |
112 |
37 |
0 |
Межатомное расстояние (Ǻ) |
2,64 |
|
1,59 |
1,24 |
1,10 |
1,21 |
1,42 |
|
67
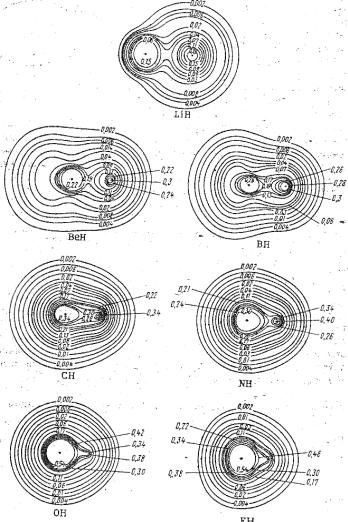
Рис.23 Контурные карты электронной плотности молекул гидридов элементов второго периода
Двухатомные молекулы, состоящие из разных атомов могут быть представлены в аналогичной форме:
C+O=CO |
C[К2s2р2]+O[К2s2р4]= CO[КК(σs)2(σs*)2(πy)2(πх)2(σz)2] |
В этой молекуле избыток связывающих электронов (6).
N+O= NO N[К2s2р3]+ O[К2s2р4]=NO[КК(σs)2(σs*)2(πy)2(πх)2(σz)2(π*х)]
Здесь связывающих электронов на один меньше, т.е. связь должна быть менее прочной. Если убрать электрон с разрыхляющей орбиты (π*х), то прочность связи возрастает. Экспериментально установлено, что энергия связи в оксиде азота равна 624 кДж/моль, а в ионе (NO+) - 880 кДж/моль. Для CO получаем принципиально другой результат: ЕСO=1072 кДж/моль, а для СO+ энергия связи уменьшается до 804 кДж/моль.
3.9 Сравнение двух методов МО и ВС.
По методу записи и решения векового определителя они неразличимы, но физический смысл и численные значения энергии различны. В ВС рассматривается двухэлектронная задача, во втором – одноэлектронная. Фигурирующие в уравнениях интегралы Н11 и Н12 и другие только при самой общей записи выглядят одинаково (это символы), но при подста-
68
новке в эти интегралы волновых функций получаются различные подинтегральные выражения. В грубом приближении МО ЛКАО приводит для молекулы водорода к значениям энергии в 2,68 эв и к равновесному расстоянию 0,85 Ǻ. Первая хуже согласуется с экспериментом, а вторая лучше, чем в ВС. Согласно МО ЛКАО в устойчивом состоянии молекула водорода имеет два электрона на связывающей орбите. Их волновые функции будут иметь вид:
ψ1мол= ϕа+ ϕв(1) и ψ2мол= ϕа+ ϕв (2) |
(207) |
следовательно, ψМО будет иметь вид |
|
ψМО=ψ1молψ2мол=ϕа(1) ϕв(2)+ϕа(2) ϕв(1)+ϕа(1) ϕа(2)+ϕв(1) ϕв(2) |
(208) |
а в ВС: |
|
ψВС=ϕа(1) ϕв(2)+ϕа(2) ϕв(1) |
(209) |
Таким образом, разница только в двух последних членах. Они соответствуют двум ионным состояниям. Два электрона у атома А или два электрона у атома В, т.е. Н-Н+ и Н+Н-. Как известно введение такой ионной связи в ВС улучшает сходимость вычислений с экспериментом. Но в МО они переучтены, поскольку входят в общее выражение с таким же весом, как первые два члена. В ВС это ионное состояние приходится вводить искусственно. Таким образом МО переоценивает роль ионной составляющей в энергии связи двух атомов, ВС их просто не учитывает. Истина всегда посередине, но то, что эти методы дают близкие результаты, указывает, что мы на верном пути, хотя возможны и радикальные изменения в наших взглядах в подходе к описанию образования химической связи.
3.10 Применение метода молекулярных орбиталей для расчета свойств органических молекул.
При описании электронной структуры многоатомных молекул используются различные разновидности полуэмпирических и неэмпирических (ab initiо) расчетных методов приближения МО ЛКАО. Наиболее простым из полуэмпирических методов является методу Хюккеля, сокращенно МОХ (1931). Коэффициенты многоцентровой МО
|
Ψ=С1ψ1+С2ψ2+С3ψ3+…..+Сhψh |
(210) |
|||||
находят по вариационному методу; вековой определитель |
|
||||||
H11 |
− ES11 |
H12 |
− ES12 ....... |
H1h − E1h S1h |
|
||
H21 |
− ES21 |
H22 |
− ES22 ........ |
H2h − ES2h |
(211) |
||
............ |
........... |
........ |
............ |
||||
|
|||||||
Hh1 |
− ESh1 |
Hh2 |
− ESh2 ........ |
Hhh − EShh |
|
||
имеет h корней. Решение дает h орбиталей (ψ1 ψ2….. ψh) с энергиями E1, E2,… Eh. В методе МОХ вводятся предположения, упрощающие решение.
Все диагональные матричные элементы определителя Н11 =∫ψiĤψidτ называемые куло-
новскими интегралами, равны между собой |
|
H11=H22=H33= …….=Hhh=α |
(212) |
69
Постулируется, что интеграл α равен энергии электрона на атомной орбитали свободного атома.
2. Недиагональные элементы Hij = ∫ψiHψjdτ, называемые резонансными интегралами, принимаются равными нулю, если ψi и ψj — атомные орбитали несоседних атомов. Это означает пренебрежение перекрыванием атомных орбиталей несоседних атомов, которое вообще невелико из-за большого расстояния между ними:
Hij(несосед)=0 |
(213) |
3. Постулируется взаимное равенство и постоянство всех резонансных интегралов для пар соседних атомов:
Hij(сосед)=β |
(214) |
4. Постулируется равенство нулю всех интегралов перекрывания: |
|
Sij = 0 |
.(214) |
Для соседних атомов из-за их близости это слишком грубое приближение. |
|
5.Интегралы Sii = 1 для нормированных АО.
6.В основном состоянии 2π электронов молекулы занимают n наиболее низких молекулярных орбиталей. Полная электронная энергия молекулы принимается равной сумме орбитальных энергий всех электронов:
i=n |
|
Емол = 2∑Еi |
(215) |
i=1
В этом приближении электронная энергия атомов равна сумме орбитальных энергий в атомах или 2nα. Таким образом, здесь не учитывается межэлектронные взаимодействия и энергия отталкивания ядер. Отсюда энергия диссоциации молекулы или сумма энергий связей равна
i=n |
|
D = 2nα −2∑Ei |
(216) |
i=1 |
|
Как будет видно далее, |
|
i=n |
|
2∑Еi = 2nα +mβ |
(217) |
i=1 |
|
где m — некоторое число, откуда |
|
D=-mβ |
(218) |
7. Кулоновский и резонансный интегралы α и β, как правило, не вычисляются из-за больших математических трудностей, а рассматриваются как параметры, т. е. служат единицами измерения; для их оценки сравнивают результат расчета энергии в единицах β и экспериментальные данные; к тому же частью интегралов полностью пренебрегают. Поэтому метод МОХ относится к полуэмпирическим. Перенос значений α и β, полученных для одного класса соединений, в другой класс (например, из полиенов в ароматические продукты) недопустим и приводит к ошибкам. Внутри одного класса такой перенос возможен и дает при расчете энергий связей и спектров приемлемые результаты.
70
