
- •Бейорганикалық қосылыстар (оксидтер. Қышқылдар. Незіздер.Тұздар). Олардың жіктелуі. Амфотерлі қосылыстар. Моль. Молярлық масса. Эквивалент. Эквивалент заңы
- •5. Заттың газ күйіндегі заңдары
- •Зат мөлшері. Моль. Авогадро заңы
- •Атом құрылысы. Электрондық конфигурация
- •Химиялық байланыс
- •Е р і т і н д і л е р . Массалық үлес.
- •Электролиттік диссоциация
- •Тұз гидролизі. Сутектік көрсеткіш
- •Тұздардың гидролизі
- •Тотығу-тотықсыздану реакциялары -ттр.
- •1.Атомаралық н/е молекулааралық ттр
- •2.Молекулаішілік ттр
- •3. Диспропорциялану ттр
- •Реакция жылдамдығы. Гетерогенді,гомогенді рекциялар
- •Химиялық термодинамика. Термохимия
- •4.1 Термодинамиканың II заңының анықтамалары
- •4.2 Энтропия
- •4.3 Әртүрлі процестер үшін энтропия өзгерістерін есептеу
- •4.3.1 Қайтымды изотермиялық процестер үшін
- •4.3.3 Идеалды газ энтропиясының өзгеруі.
- •4.3.4 Қайтымсыз процестер үшін
- •4.4 I және II термодинамиканың заңдарының біріккен теңдеуі
- •4.5 Энтропияның статистикалық мазмұны
- •4.6 Гельмгольцтың және Гиббстың бос энергиялары
- •4.7 Фазалық өзгерістер үшін термодинамиканың II заңын қолдану
- •Электрохимия. Электролиз. Гальваникалық элемент. Металдардың кернеу қатары. Коррозия
- •Комплексті қосылыстар
Реакция жылдамдығы. Гетерогенді,гомогенді рекциялар
Химиялық өзгерістердің жылдамдығы мен механизмін химияның ерекше жеке бөлімі – химиялық кинетика зерттейді.
Реакциялар гомогенді және гетерогенді болады. Гомогенді реакциялар біртекті, гетерогенді реакциялар әртекті фазалар шегінде жүреді.
Реакция жылдамдығы, әдетте, әрекеттесуші заттар концентрациясының уақыт аралығындағы өзгерісін сипаттайды. Ерітінділерде концентрация – моль/л, газдарда – парциальды қысыммен, уақыт секундпен беріледі.
Концентрация өзгерісі С=С2-С1 ал уақыт аралығы =2-1 болса, жылдамдық :
![]() Өлшем бірлігі:
моль/м 2 ∙с,
моль/м2
∙мин.
Өлшем бірлігі:
моль/м 2 ∙с,
моль/м2
∙мин.
+, - әрекеттесуші заттар концентрациясы кеміп, реакция өнімі орта болғандықтан қойылады.
Әсер етуші массалар заңы н/се массалардың әрекеттесу заңы /МӘЗ/. Тепе-теңдік константасы /Кт-т /
МӘЗ заңы: Тұрақты температурада гомогенді химиялық реакция жылдамдығы стехиометриялық коэффициенттері дәрежесінде көрсетілген әрекеттесуші заттар концентрациясының көбейтіндісіне тура пропорционал.
I. Н2+Cl2=2HCl, V=kCH2CCl2
II. 2NO+O2=2NO2, V=kC2NOCO2
k–жылдамдық константасы, ол-заттың табиғатына және температураға тәуелді.
Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен сипатталынады: температураны әр 100С-ға арттырғанда реакция жылдамдығы 2-4 есе өседі.
![]()
- реакция жылдамдығының темп-лық коэфф-ті. Мәні 2-4 аралығында болады. Мысалы, =2 болғанда, температураны 1000С-ға арттырғанда, химиялық реакция жылдамдығы 1024 рет өседі. Себебі:

соқтығысу саны бұл жағдайда небәрі 1,2 рет өседі.
Активтендіру энергиясы.
Реакцияға түскіш бөлшектерді активтілер деп, энергетикалық барьерді (асуды) жоюға қажетті энергияны активтендіру энергиясы дейді.
Әрекеттесуші заттарды активті комплекс күйіне өзгертуге, ауыстыруға қажетті энергияны активтендіру энергиясы дейміз.
Жылдамдық константасының активтендіру энергиясына тәуелділігі Аррениус теңдеуімен өрнектелінеді:
К=ZPe-Eа/RT
Z –соқтығысқан молекулалар саны әр секунд сайын;
е – натуральді логарифмнің негізі;
Р – бағытталған көбейткіш, молекуланың ыңғайлы орналасуын ескереді.
Химиялық тепе-теңдік. Кейбір химиялық реакциялар бір бағытта ғана жүреді. Мысалы: 2КClO3 2KCl+3O2
Көптеген реакциялар қайтымды. Бастапқы заттар концентрациясының азаюы, реакция өнімдерінің концентрациясының өсуіне әкеледі. Реакция өнімдері өзара әрекеттесіп, бастапқы заттар түзіледі.
NO2+CO NO+CO2
υ1=k1CNO2CCO. υ2=k2CNOCCO2.
υ1=υ2, осыдан k1CNO2CCO = k2CNOCCO2.
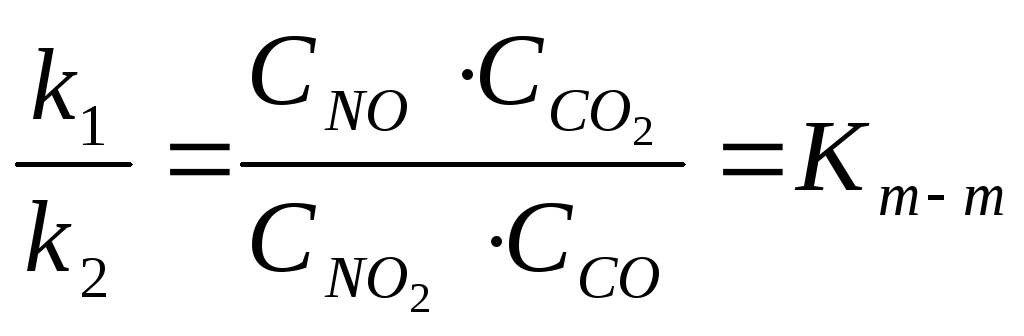 н/се Кс
н/се Кр
н/се Кс
н/се Кр
Кс-тепе-теңдік концентрациясы.
Химиялық тепе-теңдіктің ығысуы. Ле-Шателье принципі
Химиялық тепе-теңдік жағдайы көптеген факторларға байланысты: температураға, қысымға, концентрацияға және т.б. Осы факторлардың біреуін өзгерткенде химиялық тепе-теңдік ығысады. Тепе-теңдікте тұрған жүйеде барлық қоспаның концентрациясын өзгертпей-ақ, осы заттардың біреуінің ғана концентрациясын өзгертуге болмайды.
Осы жағдайды 1884ж.ғалым Ле-Шателье былай тұжырымдады: Тепе-теңдікте тұрған жүйеге сырттан әсер етсе, тепе-теңдік сол жасаған жағдайға қарама-қарсы жаққа қарай ығысады.
Тепе-теңдік күйдегі жүйеге сырттан әсер еткенде, жүйеде осы әсерді азайтатын процесс күшейеді:
3H2+N2 2NH3+46,2кДж
$$$ 184
2NO(г)+O2(г) 2NO2(г) гомогенді реакцияның жылдамдығына сәйкес келетін өрнектердің қайсысы дұрыс?
А)
= k2CNO![]() ;
;
В)
= k![]()
![]() ;
;
С)
= 2k![]() CNO;
CNO;
D)
= k![]() +
+![]() ;
;
Е)
= k![]() .
.
$$$ 185
S(к)+O2(г) SO2(г) гетерогенді реакцияның жылдамдығына сәйкес келетін өрнектердің қайсысы дұрыс?
А)
= kCS![]() ;
;
В)
= k![]() ;
;
С)
= kCS+![]() ;
;
D)
= k![]() ;
;
Е)
= kCS![]()
![]() .
.
Реакция жылдамдығының температуралық коэффициентi неге тең, егер температураны 400С-ге жоғарылатқанда реакция жылдамдығы 81 есе артса?
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 207
Қайтымды реакцияның қайсысында, қысымды жоғарылатқанда тепе-теңдiк тура реакция бағытына ығысады:
А) H2+I2 Û 2HI;
В) C+СO2 Û 2CO;
С) N2+O2 Û 2NO;
D) N2+3H2 Û 2NH3;
Е) 2HBr Û H2+Br2.
$$$ 208
Берiлген реакцияның 2NO(г)+O2(г) = 2NO2(г) жылдамдығы қалай өзгередi, егер көлемдi 3 есеге азайтса?
А) 6 есе төмендейді;
В) 20 есе артады;
С) өзгермейді;
D) 27 есе артады;
Е) 2 есе төмендейді.
$$$ 209
Берiлген реакцияның N2(г)+3Н2(г) Û 2NН3(г) жылдамдығы қалай өзгередi, егер жүйедегi қысымды 3 есе арттырса?
А) 3 есе азаяды;
В) 27 есе артады;
С) 81 есе артады;
D) өзгермейді;
Е) 120 есе артады.
$$$ 210
А2(г)+В2(г) Û 2АВ(г) реакцияның тепе-теңдiгi қай бағытқа ығысады, егер бiр уақытта қысымды 2 есе, температураны 100С-ке арттырса? Тура реакцияның температуралық коэффициентi 2-ге, керi реакцияның 3-ке тең.
А) солға;
В) оңға;
С) өзгермейді;
D) оңға, егер темп. коэф.=2;
Е) оңға, егер темп. коэф.=3.
$$$ 211
Реакцияның жылдамдық константасы қай шамаға тәуелдi:
А) көлем мен температураға;
В) әрекеттесетін заттардың табиғатына;
С) жүйедегі қысымға;
D) әрекеттесетін заттардың концентрациясына;
Е) қысым мен температураға.
$$$ 212
2А+В®А2В реакция жылдамдығы қалай өзгередi, егер А-заты концентрациясын 2 есе арттырып, ал B заты концентрациясын 2 есе азайтса?
А) 2 есе артады;
В) 4 есе артады;
С) 8 есе артады;
D) өзгермейді;
Е) 16 есе артады.
$$$ 213
Температураны 200С-тен 700С-ке арттырғанда реакция жылдамдығы қанша есе артады, егер реакцияның температуралық коэффициентi 2-ге тең болса
А) 10 есе;
В) 15 есе;
С) 32 есе;
D) 16 есе;
Е) 30 есе.
$$$ 214
Келтiрiлген реакция N2+3Н22NН3 жылдамдығының математикалық теңдеун жазыңыз:
А)
=k1![]()
![]() ;
;
В) =k1N2;
С)
=k1![]() ;
;
D)
=k1![]() ;
;
Е)
=k1![]() +
+
![]() .
.
$$$ 215
Химиялық реакция жылдамдығының катализатор қатысуымен артуына үлесiн тигiзетiн:
А) активтену энергиясының артуы;
В) активтену энергиясының төмендеуi;
С) молекулалардың соқтығысу жиiлiгiнiң артуы;
D) реакция жылуының өсуi;
Е) реакция жылуының төмендеуi.
$$$ 216
Әрекеттесушi заттар концентрациясын арттырғанда реакция жылдамдығы:
А) артады;
В) төмендейді;
С) өзгеріссіз қалады;
D) бастапқыда артып, сонан соң төмендейдi;
Е) бастапқыда төмендейдi, сонан соң артады.
$$$ 217
2NO+O2®2NO2+Q реакция тепе-теңдiгi солға қарай қай жағдайда ығысады?
А) О2 концентрациясын арттыру;
В) температураны арттыру;
С) NO концентрациясын арттыру;
D) қысымды арттыру;
Е) NO2 концентрациясын азайту
$$$ 218
Вант-Гофф ережесiне сәйкес, температураны әрбiр 100С-ке көтергенде реакция жылдамдығы?
А) өзгермейді;
В) 2-4 есе өседі;
С) азаяды;
D) 10-20 есе артады;
Е) 5-10 есе кемиді.
$$$ 219
Гомогенді реакцияны көрсетіңіз.
А) С(қ)+О2(г)=СО2(г)
В) 4Al(қ)+3О2(г)=2Al2О3(қ)
С) CaСO3(қ) CaО(қ)+СО2(г)
D) N2(г)+3Н2(г) 2NН3(г)
Е)
2KClO3(қ)
![]() 2KCl(қ)+3О2(г)
2KCl(қ)+3О2(г)
$$$ 220
4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) реакциясының жылдамдығы HCl концентрациясын 2 есе өсiргенде қанша есе өседi?
А) 2;
В) 32;
С) 8;
D) 16;
Е) 34.
$$$ 221
Газдық фазада жүрiп жатқан реакцияның температурасын 320 дан 340К өсiргенде реакция жылдамдығы қанша есе өседi, егер =3?
А) 8;
В) 9;
С) 6;
D) 3;
Е) 10.
$$$ 222
СО(г)+Н2О(г)=СО2(г)+Н2(г) реакцияның жылдамдығын 36 есе арттыру үшін қысымды қалай өзгерту керек
А) 3 есе арттыру;
В) 6 есе арттыру;
С) 12 есе арттыру;
D) 4,5 есе арттыру;
Е) 9 есе арттыру.
$$$ 223
Реакция жылдамдығын 81 есе азайту үшiн температураны қанша градусқа төмендету керек, егер =3 болса?
А) 200;
В) 300;
С) 200;
D) 400;
Е) 90.
$$$ 224
Fe3O4(қ)+4CO(г) Û 3Fe(қ)+4CO2(г) реакцияның тепе-теңдігі қысымды арттырғанда қалай өзгереді:
А) солға қарай ығысады;
В) СО2 түзілу жағына ығысады;
С) оңға қарай ығысады;
D) ығыспайды;
Е) Fe3O4 түзілу жағына ығысады.
$$$ 225
N2(г)+3H2(г) Û 2NH3(г) жүйесiндегi тепе-теңдiктi оңға, яғни аммиак түзiлу жағына ығыстыру үшiн:
А) қысымды арттыру керек;
В) қысымды кеміту керек;
С) аммиактың концентрациясын арттыру керек;
D) температураны азайту керек;
Е) газдардың көлемін арттыру керек.
$$$ 226
2CO(г)+O2(г) Û 2CO2(г)+Q жүйесiндегi тепе-теңдiктi солға, яғни бастапқы заттар жағына ығыстыру үшiн:
А) СО-нің концентрациясын арттыру керек;
В) О2-нің концентрациясын арттыру керек;
С) СО2-нің концентрациясын азайту керек;
D) температураны арттыру керек;
Е) қысымды арттыру керек.
$$$ 228
Химиялық реакцияның жылдамдығы қалай өзгереді, егер әрекеттесетін заттардың концентрациясын арттырса?
А) азаяды;
В) артады;
С) өзгеріссіз қалады;
D) реакция өнімдерінің концентрациясы азаяды;
Е) реакция өнімдерінің концентрациясы өзгермейді.
$$$ 229
Гетерогендi реакция үшiн С(қ)+СО2(г) 2СО(г) әсер етушi массалар заңының қайсы өрнегi дұрыс?
А)
=
k
![]() ;
;
В)
=
k
![]() ;
;
С)
=
k
+![]() ;
;
D)
=
k
![]()
![]() ;
;
Е)
=
k
2![]() .
.
$$$ 231
Химиялық реакция жылдамдығының өлшем бірлігі:
А) моль/л;
В) моль/сек;
С) моль/лсек;
D) л/моль;
Е) г/моль.
$$$ 232
Әсеретушi массалар заңың қолданып 2A + B C реакцияның жылдамдығын анықтаңыз:
А) = k[A][B];
В) = k[C]2;
С) = k[A];
D) = k[A]2[B];
Е) = k[B].
$$$ 236
Әсеретушi массалар заңың қолданып A +3D 2C реакцияның жылдамдығын анықтаңыз:
А) = k[C];
В) = k[A];
С) = k[D];
D) = k[A][D]3;
Е) = k2[C].
$$$ 240
2Н2
+ СО
![]() СН3ОН
реакция үшін тепе-теңдік константасын
өрнектеңіз:
СН3ОН
реакция үшін тепе-теңдік константасын
өрнектеңіз:
А)
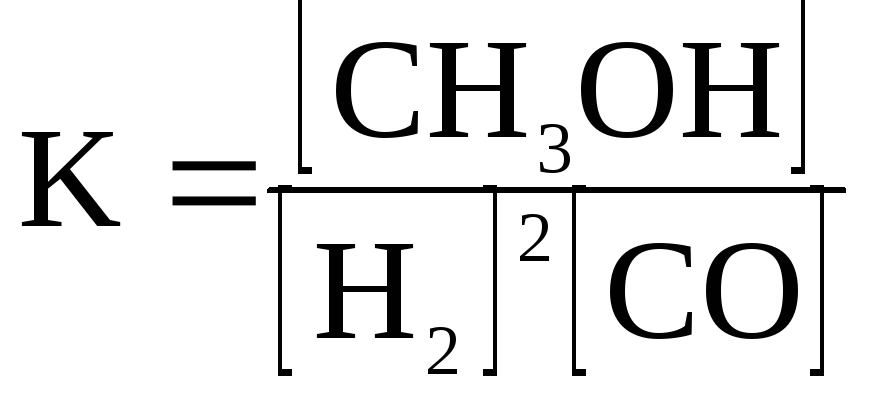 ;
;
В)
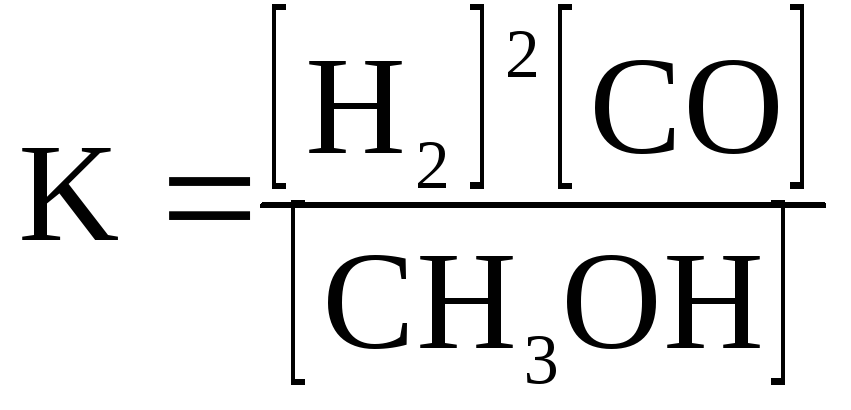 ;
;
С)
![]() ;
;
D)
![]() ;
;
Е)
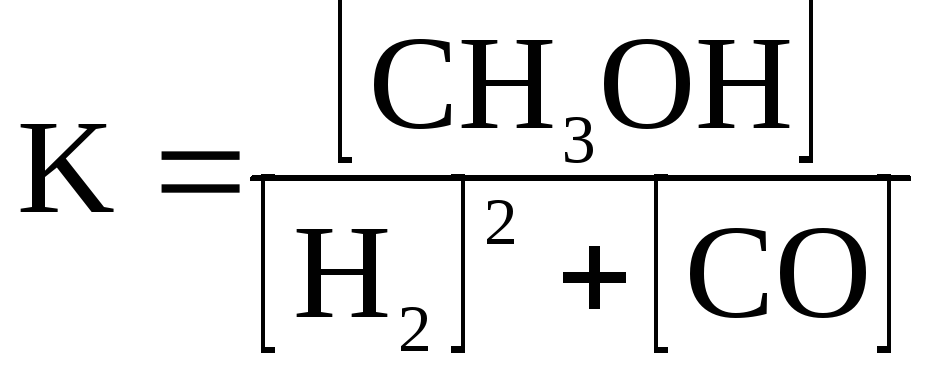 .
.
