
- •Бейорганикалық қосылыстар (оксидтер. Қышқылдар. Незіздер.Тұздар). Олардың жіктелуі. Амфотерлі қосылыстар. Моль. Молярлық масса. Эквивалент. Эквивалент заңы
- •5. Заттың газ күйіндегі заңдары
- •Зат мөлшері. Моль. Авогадро заңы
- •Атом құрылысы. Электрондық конфигурация
- •Химиялық байланыс
- •Е р і т і н д і л е р . Массалық үлес.
- •Электролиттік диссоциация
- •Тұз гидролизі. Сутектік көрсеткіш
- •Тұздардың гидролизі
- •Тотығу-тотықсыздану реакциялары -ттр.
- •1.Атомаралық н/е молекулааралық ттр
- •2.Молекулаішілік ттр
- •3. Диспропорциялану ттр
- •Реакция жылдамдығы. Гетерогенді,гомогенді рекциялар
- •Химиялық термодинамика. Термохимия
- •4.1 Термодинамиканың II заңының анықтамалары
- •4.2 Энтропия
- •4.3 Әртүрлі процестер үшін энтропия өзгерістерін есептеу
- •4.3.1 Қайтымды изотермиялық процестер үшін
- •4.3.3 Идеалды газ энтропиясының өзгеруі.
- •4.3.4 Қайтымсыз процестер үшін
- •4.4 I және II термодинамиканың заңдарының біріккен теңдеуі
- •4.5 Энтропияның статистикалық мазмұны
- •4.6 Гельмгольцтың және Гиббстың бос энергиялары
- •4.7 Фазалық өзгерістер үшін термодинамиканың II заңын қолдану
- •Электрохимия. Электролиз. Гальваникалық элемент. Металдардың кернеу қатары. Коррозия
- •Комплексті қосылыстар
Тотығу-тотықсыздану реакциялары -ттр.
ТТР-электрондардың тотықсыздандырғыштан тотықтырғышқа өтуi нәтижесiнде тотығу дәрежелерi өзгеретiн реакциялар.
Тотығу дәрежесi-молекула құрамындағы атомның жанамадан алған заряды.
Д.И.Менделеев кестесіндегі орнына байланысты элементтердiң тотығу дәрежелерi ең төменгi (-4) дәрежесiнен 8-ге тең дәреже арқылы ең жоғарғы дәрежесiне (+8) дейiн өзгередi.
Менделеев кестесіндегі I, II және III топ элементтерiнiң ион түрiнде тотығу дәрежелерi тұрақты, яғни өзгермейдi. Мысалы: – Н+, Са+2, Аl+3. Барлық басқа топ элементтерiнiң тотығу дәрежелерi тұрақсыз және бiр элементтiң өзi бiрнеше тотығу дәрежелерiн көрсетуi мүмкiн.
Мысалы: марганецтiң төмендегiдей қосылыстары бар:
|
Мn0 |
Мn+2 |
Mn+4 |
Mn+6 |
Mn+7 |
|
|
MnO |
MnO2 |
MnO3 |
Mn2O7 |
|
|
Mn(OH)2 |
|
H2MnO4 |
HMnO4 |
Тотығу дәрежесi тұрақсыз элемент атомының тотығу дәрежесiн табу үшiн молекула құрамындағы элементтердiң зарядтарының алгебралық қосындысы 0-ге тең деп аламыз. Мысалы:
|
H2S |
+12+X=0 |
X=-2 |
S-2 |
|
H2SO3 |
+12+X-23=0 |
Х=6-2=4 |
S+4 |
|
H2SO4 |
12+X-24=0 |
Х=8-2=+6 |
S+6 |
Электрондарды (“е-”) берiп жiберу тотығу процесi, болшек- тотықсыздандырғыш деп аталады. Мысалы:
Z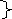 n0-2e=Zn+2
Zn
n0-2e=Zn+2
Zn
S-2-6e=S+4 S-2 тотықсыздандырғыштар
Тотығу процесi кезiнде тотығу дәрежесi өседi.
Электрондарды “е-” қосып алуы тотықсыздану процесi, бөлшек-тотықтырғыш деп аталады Мысалы:
M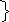 n+7+5e=Mn+2
Mn+7
және
Fe+3
– тотықтырғыштар
n+7+5e=Mn+2
Mn+7
және
Fe+3
– тотықтырғыштар
Fe+3+e=Fe+2
Тотықсыздану процесi кезiнде тотығу дәрежесi төмендейдi.
Галогендер ең жоғарғы (максималды) тотығу дәрежесiн көрсетеді. Олар “е” оңай қосып алады.
Валенттiк электрондарын (1,2,3) оңай берiп жiберетiндер тотықсыздандырғыштар болады. Бұларға сыртқы электрондық деңгейiнде 1,2,3 электрондар бар металдар жатады.
Ең жоғарғы және ең төменгi тотығу дәрежелерiнiң ортасындағы тотығу дәрежесiн көрсететiн иондар екi жақты қасиет көрсетедi, яғни, олар әрi тотықтырғыш, әрi тотықсыздандырғыш бола алады. Мысалы:
Mn+7+5e=Mn+2 тотықтырғыш
S+4-2e=S+6 тотықсыздандырғыш
S-2-2e=S0 тотықсыздандырғыш
S+4+4e=S0 тотықтырғыш
ТТР үш ортада қышқылдық, бейтарап және сiлтiлiк ортада жүруi мүмкiн.
ТТР теңестірудің екі тәсілі бар: электронды баланс және электронды – иондық баланс әдісі немесе жартылай реакция әдісі.
K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
2 Сr+6+6e=2Cr+3
1
Сr+6+6e=2Cr+3
1
N+3-2e=N+5 3
Бұл әдіс – электрондық баланс әдісі.
Енді электронды- иондық баланс әдісі немесе жартылай реакция әдісі:
K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
1) Cr2O72- →2Cr3+.
Бұл әдіс реакцияның оң және сол жақ бөліктеріндегі атомдар балансына әкеліп соғады. ТТР рН<7 ортада жүргендіктен суды қолдануға болады. Реакцияның оң жақ бөлігіне сол жақ бөлігіндегі оттегінің санына байланысты 7 моль су қосамыз:
C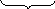
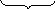 r2O72-+14Н++6е→2Сr3++7Н2О
r2O72-+14Н++6е→2Сr3++7Н2О
+12 +6
Реакцияның оң жағында 14Н+ пайда болғандықтан сол жағын баланс үшін теңестіріп жазамыз. Енді зарядтар балансын тексереміз.
2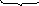
 )
NO2-+H2O-2e→NO3-+2H+
)
NO2-+H2O-2e→NO3-+2H+
Екінші теңдікте де сол жақта жетіспеген оттегі Н2О көмегімен енгізіледі де, оң жаққа 2Н+ қосылады, зарядтар балансы (-2е-).
Осы теңдіктерді қатар жазып, беріп жіберген және қосып алған «е» балансы үшін қойылатын коэффициентті табамыз:
 1
Cr2O72-+14Н++6е=2Сr3++7Н2О
1
Cr2O72-+14Н++6е=2Сr3++7Н2О
3 NO2-+H2O-2e=NO3-+2H+
Коэффициентті 3-ке көбейтіп, екі теңдікті біреу етіп жазамыз, ол үшін «+6е-» мен «-6е-» қысқартамыз:
Cr2O72-
+
14Н++
3NO2-+
3H2O
=2Cr+3+
7H2O+
3NO3-
+6H+
8 4 3K+
2K+ 4SO42- 3K+ 3SO42- 2K++SO42-
Жетіспей тұрған K+ катионы мен SO42- анионын қосып, толық реакция теңдігін жазамыз:
K2Cr2O7+4H2SO4+3KNO2=Cr2(SO4)3+4H2O+3KNO3+K2SO4
ТТР жіктелуі:
1.Атомаралық н/се молекулааралық-әртүрлі молекуладағы элементтердің тотығу дәрежесінің өзгеруі арқылы жүреді:
Ғе+3Сl3-
+ 2Н+I
-![]() 2Ғе+2СI2-
+I20
+HCl
2Ғе+2СI2-
+I20
+HCl
2.Молекула ішілік – бір молекула құрамындағы элементтердің тотығу дәрежесі өзгереді:
2
К+Cl+5O3-2
![]() 2K+Cl-
+3O20
2K+Cl-
+3O20
3.Диспропорциялану – бір элементтің тотығу дәрежесін әрі жоғарылату, әрі төмендету арқылы жүруі.
4
К+Cl+5O3
-2
![]() 2К+Cl+7O4-2
+K+Cl-
2К+Cl+7O4-2
+K+Cl-
KMnO4 күшті тотықтырғыш қандай ортада: қышқылдық
ТТР-да т-ш,т-с-ш болатын : (Н2О2)
