
- •Бейорганикалық қосылыстар (оксидтер. Қышқылдар. Незіздер.Тұздар). Олардың жіктелуі. Амфотерлі қосылыстар. Моль. Молярлық масса. Эквивалент. Эквивалент заңы
- •5. Заттың газ күйіндегі заңдары
- •Зат мөлшері. Моль. Авогадро заңы
- •Атом құрылысы. Электрондық конфигурация
- •Химиялық байланыс
- •Е р і т і н д і л е р . Массалық үлес.
- •Электролиттік диссоциация
- •Тұз гидролизі. Сутектік көрсеткіш
- •Тұздардың гидролизі
- •Тотығу-тотықсыздану реакциялары -ттр.
- •1.Атомаралық н/е молекулааралық ттр
- •2.Молекулаішілік ттр
- •3. Диспропорциялану ттр
- •Реакция жылдамдығы. Гетерогенді,гомогенді рекциялар
- •Химиялық термодинамика. Термохимия
- •4.1 Термодинамиканың II заңының анықтамалары
- •4.2 Энтропия
- •4.3 Әртүрлі процестер үшін энтропия өзгерістерін есептеу
- •4.3.1 Қайтымды изотермиялық процестер үшін
- •4.3.3 Идеалды газ энтропиясының өзгеруі.
- •4.3.4 Қайтымсыз процестер үшін
- •4.4 I және II термодинамиканың заңдарының біріккен теңдеуі
- •4.5 Энтропияның статистикалық мазмұны
- •4.6 Гельмгольцтың және Гиббстың бос энергиялары
- •4.7 Фазалық өзгерістер үшін термодинамиканың II заңын қолдану
- •Электрохимия. Электролиз. Гальваникалық элемент. Металдардың кернеу қатары. Коррозия
- •Комплексті қосылыстар
Химиялық термодинамика. Термохимия
Химиялық термодинамика – химиялық реакция кезінде байқалатын энергияның бір түрден басқа түрге айналуын, реакциялардың бағытын және реакциялардың осы жағдайда өздігінен жүру шегін, сонымен қатар химиялық тепе-теңдіктің болу жағдайларын анықтайтын ғылым.
Термодинамиканың 1-ші заңының матем.өрнегі: Q=∆U+A
Жүйе күйенің шексіз аз өзгерістерімен байланысты үрдістер үшін термодин.1-ші заңының матем. өрн., изохора проц.: dU = δQ + δA
Изобаралық проц. энергияның толық қоры Н – энтальпиямен сипаталады. ∆Н = ∆U + р∆V; ∆U мен ∆Н-күй функциялар; δQ ж/е δA
күй функциялары емес, олар жүйені процесс кезінде сипаттайды.
Газ тәрізді заттар үшін: ∆Н = ∆U + ∆νRT
Г.И. Гесс заңы. Жылу эффектісі және әрекеттесуші заттардың агрегаттық күйі көрсетілген химиялық реакция теңдеулерін термохимиялық теңдеулер деп атайды.
СН4(г)+2О2(г)=СО2(г)+2Н2О(с)+802кДж
298К н/се 25ºС ж/е р0-101,3кПа н/се1атм. қ.ж.-ғы мәнді стандартты жылу эффектісі деп Н0f,298 белгілейді, /кДж, ккал/.
Іс жүзінде жылу эффектілерін калориметрмен анықтайды.
Петербург химигі Г.И.Гесс 1840ж.тұжырымдаған: реакцияның жылу эффектісі оның жүрген жолына тәуелді емес, тек қана алынған зат пен реакция өнімінің табиғатымен және күйімен анықталынады.
∆rНº298 = ∑νөн.∆Нƒ, 298 өн. ∑νбас.∆Нƒ,298 баст.
ƒ – инд. ағылш. «formation» - түзілу.
Процестердің бағыты. Изобаралық потенциал. Гиббс энергиясы
Термодинамиканың екінші заңы бойынша ішкі энергия және энтальпия: U = F + TS; H = G + TS
Гиббс(G) және Гельмгольц (F) энергиялары жүйенің термодинамикалық күй функциялары, оларды «еркін» энергиялар деп атайды. Жүйенің ішкі энергиясының қалған бөлігі жұмысқа ауыса алмайды, жүйеде қалып қояды және сол себептен «байланысқан» энергия деп аталады.
Байланысқан энергия жүйенің энтропиясымен анықталады және ол абсолюттік температураны энтропия өзгерісіне көбейткенге тең, яғни TdS немесе TΔS:
dG ≤ dH − TdS ; ΔG ≤ ΔH − TΔS
dF ≤ dH − TdS ; ΔF ≤ ΔH − TΔS
Бұл теңдеулер Т-const. ж/е V-const. н/се сәйкес қысымда қайтымды (=) және қайтымсыз (<) үрдістер үшін жазылған.
Термодинамикалық функция өзгерістерін (ΔG, ΔF) кез келген реакция үшін жылу эффектілері сияқты Гесс заңы бойынша есептейді. Қ.ж. (25°С және 101325 Н/м2) термодинамикалық функцияның шамалары анықтама кітабында беріледі: Gºреак=Gºөнім-Gºбаст.зат. /кДж/моль, ккал/моль./
Жай заттың ең тұрақты модификациясының түзілуінің G0298 –мәні нөлге тең .
Термодинамиканың 2-ші заңының матем.өрнегі: dS ≥ δQ/T ; ΔS ≥ Q/T
мұнд.: > белгісі қайтымсыз, ал = белгісі қайтымды үрдістер үшін.
Энтропия S – термодинамикалық күй функциясы, ол экстенсивтік қасиет көрсетеді, яғни жүйенің массасына тәуелді; /Дж/моль•К./
Термодинамикалық ықтималдық W мен жүйенің ретсіздікке ұмтылуын сипаттайтын термодинамикалық күй функциясы энтропия S арасындағы байланыс Больцман формуласымен өрнектеледі: S = klnW
k − Больцман конст., 1,38 · 10 23 Дж/к.
Ішкі энергия мен энтальпиядан өзгешелігі энтропияның абсолюттік мәні анықталған болу мүмкіндігі. Энтропия мәні заттардың табиғатына (молекула күрделенген сайын оның энтропиясының жоғарылауы, мысалы, S0CO =197Дж /моль·К, ал S0CO2 = 214 Дж/моль·К) және агрегаттық күйіне (ең үлкен энтропия мәні газ тәріздес күйдегі, кішілері сұйық және қатты заттарда , мысалы, S0H2O(с) = 70 Дж/моль·К , ал S0 H2O(г) = 189 Дж/моль·К).
Қ.ж. Т=298К ж/е р=1,013·105Па (1атм.) стандарттық энтропия S0 болады. ∆Sреак. = ∑(νi Ѕ°)өнім - ∑(νi Ѕ°)баст.
Термодинамика заңы бойынша: жай заттың түзілу энтальпиясынан өзгешілігі жай затттың энтропиясы нольге тең болмайды.
Термодинамиканың I заңы.
Физикалық химия – химиялық құбылыстар мен химиялық процестердің заңдылықтарын зерттейтін ғылым.
Термодинамиканың негізгі түсініктері. Жүйе дегеніміз кеңістіктің бір бөлігі. Ашық жүйе қоршаған ортамен энергияны және затты алмастырадын жүйе..Жабық жүйе – қоршаған ортамен тек энергияны алмастырадын жүйе.
Оқшауланған жүйе - қоршаған ортамен затты да, энергияны да алмастырмайтын жүйе. Оқшауланған жүйенің ішкі энергиясы тұрақты шама.
Жүйелер гомогенді және гетерогенді деп екі топқа бөлінеді.
Гомогенді жүйе деп біркелді, бірфазалы жүйені айтады.
Гетерогенді жүйе деп біркелкісіз, көпфазалы жүйені айтады.
Фаза деп жүйенің басқа бөліктерінен шекарамен бөлінген, кез-келген нүктесінде физикалық және химиялық қасиеттері бірдей жүйенің бір бөлігін айтады.
Энтальпия - ішкі энергия, көлем және қысым арасындағы байланысты көрсетеді және өзі кеңіген жүйенің ішкі энергиясы болып келеді:
Н = U + PV (3.1)
dН = dU + PdV +VdP
U, P, V – күй функциялары, өйткені оның өзгерісі процестің жүру жолына тәуелсіз.
Жылу мен жұмыс процестің функциялары болып саналады. Жылу мен жұмыстың мөлшері жүйенің бір күйден басқа күйге ауысқандағы жүру жолына тәуелді.
Жылусыйымдылық. Заттың бір грамының не бір молінің температурасын бір градусқа көтеру үшін жұмсалатын жылу мөлшерін жылусыйымдылық деп атайды. Заттардың жылусыйымдылығы температураға тәуелді, сондықтан жылусыйымдылықтың мәні нақтылы және орташа болып бөлінеді.
Орташа жылусыйымдылық деп берілген екі температура аралығындағы оның мәнін айтады:
![]() (3.2)
(3.2)
Нақтылы жылусыйымдылық деп берілген температурадағы жүйе жылусыйымдылығын айтады:
![]() (3.3)
(3.3)
Заттың 1 кг тиісті жылусыйымдылық – меншікті жылусыйымдылық деп, ал 1 моліне тиістісі мольдік жылусыйымдылық деп аталады.
Процесті өткізу жағдайына байланысты жылусыйымдылықты (P=const) изобаралық Ср және (V=const) изохоралық Cv деп бөледі.
Жылусыйымдылықтың мәніне температура үлкен әсер етеді.
Жылусыйымдылықтың температураға тәуелділігі дәрежелік қатарлармен беріледі:
органикалық қосылыстар үшін: Ср = a + bT +cT2 + dT3
анорганикалық қосылыстар үшін: Ср = a + bT +c1 T-2
a, b, c, d, c1 – заттардың табиғатына тәуелді коэффициенттер.
Термодинамиканың I заңының анықтамалары және математикалық теңдеуі
Iші термодинамиканың заңын М.В. Ломоносов 1748ж. ашқан, ол жалпы энергия сақталу заңының салдары болып келеді; оның бірнеше анықтамалары бар:
1. энергия жойылмайды, жоқтан пайда болмайды, ол тек қана бір түрден басқа түрге қатаң эквивалентті мөлшерде ауысады.
2. кез-келген оқшауланған жүйеде энергияның жалпы қоры тұрақты сақталады.
3. Iші текті мәңгілі қозғалтқыш болуы мүмкін емес. Кез-келген процесс үшін жүйенің ішкі энергиясының көбеуі ∆U=U2-U1 жүйеге берілген жылу мөлшері (q) мен жүйемен атқарылған жұмыс мөлшерінің (А) айырымына тең.
![]()
Шексіз аз мөлшерінде жүретін процестер үшін термодинамиканың Iші заңы келесі түрде жазылады:
![]()
Қарапайым процестер үшін термодинамиканың I заңының қолдануы
1. Изохоралық процесс (V = const):
А = 0, онда qv = DU
2. Изобаралық процесс (Р=const):
Ap = P (V2 - V1) = P DV (3.9)
qp = DU + P DV , яғни
DH = DU + PDV, онда
qp = DH (3.10)
3. Изотермиялық процесс (T = const).
Менделеев-Клапейронның
теңдеуінен қысымның мәнін көрсетеміз:
![]() , оны жұмыстың теңдеуіне қоямыз:
, оны жұмыстың теңдеуіне қоямыз:
![]() ;
; ![]() ,
,
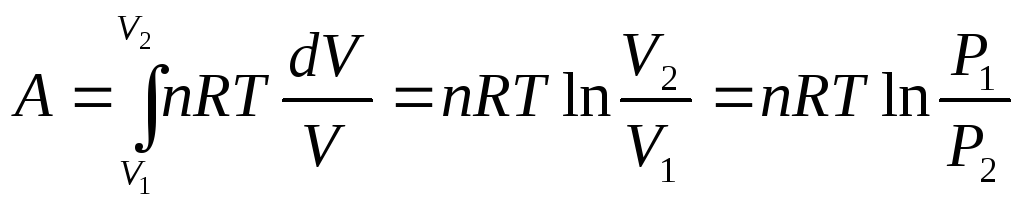 (3.11)
(3.11)
T = const жағдайда, ∆U = 0 екенін есепке алып, изотермиялық процестер үшін термодинамиканың I заңы келесі теңдеу түрінде болады
qT=AT (3.12)
4. Адиабатикалық процесс қоршаған ортамен жылу алмастырмайды, яғни q = 0, сондықтан
A = - DU (3.13)
Адиабатикалық процестін жұмысы жүйенің ішкі энергиясының кеміуі арқылы атқарылады. Ол келесі теңдеумен есептеледі:
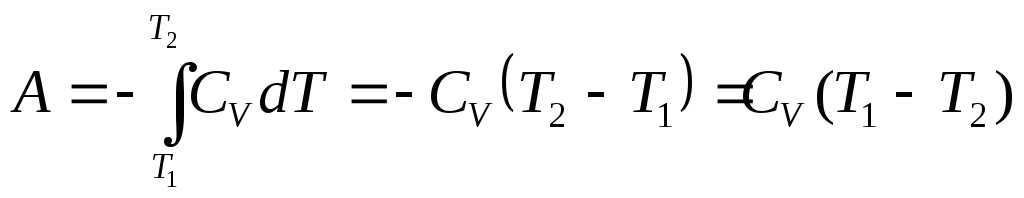 (3.14)
(3.14)
Термохимия.
Термохимия деп химиялық реакциялардың жылулық эффектілерін зерттейтін химиялық термодинамиканың бөлігін айтады.
Реакция жүргенде бөлінген немесе жұтылған жылу мөлшерін химиялық реакцияның жылу эффектісі деп айтады. Реакция келесі жағдайларда жүру қажет:
1) P = const; Т = const болғанда, реакция қайтымсыз болуы қажет;
2) кеңу жұмысынан басқа жүйеде ешқандай жұмыстар атқарылмау қажет;
3) реакция өнімдерінің және бастапқы заттардың температуралары бірдей болуы қажет.
V = const және P= const жағдайлардағы химиялық реакциялардың жылуларын жылу эффектілер деп атайды: qV = DU; qP = DН.
Реакция жүргенде жылу жұтылатын болса, DН > 0, мұндай реакциялар эндотермиялық реакциялар деп аталады.
Реакция жүргенде жылу бөлінетін болса, DН < 0, мұндай реакциялар экзотермиялық реакциялар деп аталады.
V =const және P = const жылу эффектілерінің арасындағы байланысты келесі теңдеу көрсетеді:
qP = qV + DnRT, (3.15)
мұнда: Dn – реакцияға қатысатын газды заттардың моль санының өзгеруі.
Термохимиялық реакцияны жазғанда заттардың агрегатты күйлерін ескеру қажет.
Гесс заңы
V = const және P=const жағдайларда химиялық реакцияның жылу эффектісі реакцияның жолына тәуелсіз, ол тек жүйенің бастапқы және соңғы күйлерімен анықталады.
Гесс заңы эксперименталды түрде анықтауға келмейтін химиялық реакциялардың жылу эффектілерін есептеуге мүмкіншілік береді.
Гесс заңының салдарлары:
I. Реакцияның түзілу жылу эффектісі реакция өнімдері мен бастапқы заттарының түзілу жылуларының қосындыларының айырымына тең.
![]()
![]() (3.16)
(3.16)
мұнда: DНr – реакцияның түзілу жылу эффектісі
D fН0 – 1 моль заттың қарапайым заттардан түзілу жылуы.
II. Реакцияның жылу эффектісі реакцияға түскен заттар мен реакция өнімдерінің жану жылуларының қосындыларының айырымына тең
![]()
![]() (3.17)
(3.17)
Жану жылу деп берілген жағдайларда 1 моль заттың жоғары оксидтерге дейін тотыққанда бөлініп шығатын жылуды айтады.
Реакция жылу эффектісінің температураға тәуелділігі
Молярлық жылусыйымдылықтардың теңдеулерін жазайық:
![]() және
және
![]() (3.18)
(3.18)
Жылусыйымдылықтың шамалы өзгеруі келесі теңдеулермен көрсетіледі:
![]() (3.19)
(3.19) ![]() (3.20)
(3.20)
(3.19) және (3.20) теңдеулер Кирхгофтың дифференциалды теңдеулері деп аталады. Олар жылу эффектінің температуралық коэффициентінің реакция өнімдері мен бастапқы заттардың қосындыларының айырымына тең екенін көрсетеді.
(3.19)-ші теңдеуді талдайық.
1.
Егер DСР
> 0, онда
![]() . Температура жоғарлаған сайын реакцияның
жылу эффектісі өседі.
. Температура жоғарлаған сайын реакцияның
жылу эффектісі өседі.
2.
Егер DСр
< 0, онда
![]() . Температура жоғарылаған сайын реакцияның
жылу эффектісі кемиді.
. Температура жоғарылаған сайын реакцияның
жылу эффектісі кемиді.
3.
Егер DСР
= 0, онда
![]() . Реакцияның жылу эффектісі температураға
тәуелсіз.
. Реакцияның жылу эффектісі температураға
тәуелсіз.
Т1 және Т2 аралығында Кирхгоф теңдеуін интегралдасақ келесі теңдеулерді аламыз:
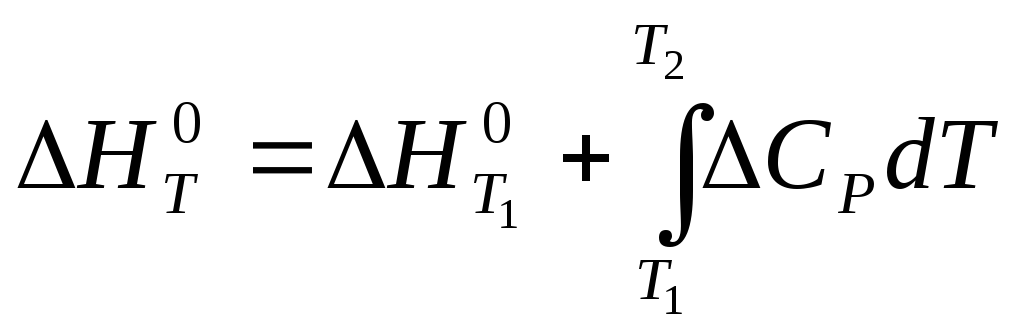 (3.21)
(3.21)
Т1 = 298К тең деп алатын болсақ, онда Кирхгофтың теңдеу былай өзгереді:
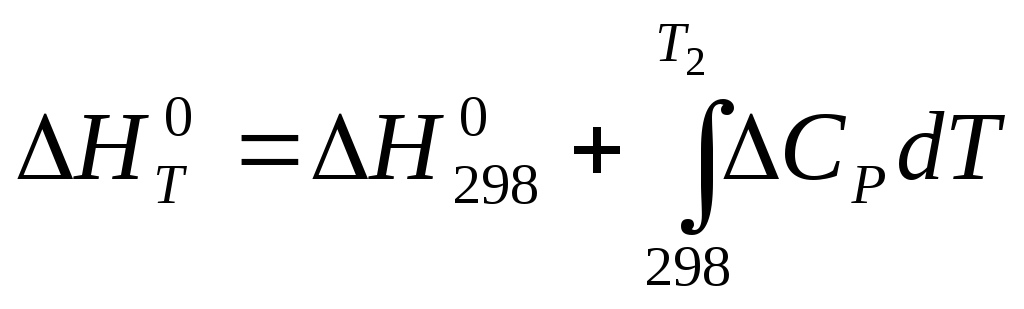 (3.22)
(3.22)
(3.21) және (3.22) теңдеулер интегралды түрдегі Кирхгоф теңдеулері.
Егер D CP = const, онда (3.22) келесі түрде болады:
Термодинамиканың екінші заңы. Энтропия
