
- •Бейорганикалық қосылыстар (оксидтер. Қышқылдар. Незіздер.Тұздар). Олардың жіктелуі. Амфотерлі қосылыстар. Моль. Молярлық масса. Эквивалент. Эквивалент заңы
- •5. Заттың газ күйіндегі заңдары
- •Зат мөлшері. Моль. Авогадро заңы
- •Атом құрылысы. Электрондық конфигурация
- •Химиялық байланыс
- •Е р і т і н д і л е р . Массалық үлес.
- •Электролиттік диссоциация
- •Тұз гидролизі. Сутектік көрсеткіш
- •Тұздардың гидролизі
- •Тотығу-тотықсыздану реакциялары -ттр.
- •1.Атомаралық н/е молекулааралық ттр
- •2.Молекулаішілік ттр
- •3. Диспропорциялану ттр
- •Реакция жылдамдығы. Гетерогенді,гомогенді рекциялар
- •Химиялық термодинамика. Термохимия
- •4.1 Термодинамиканың II заңының анықтамалары
- •4.2 Энтропия
- •4.3 Әртүрлі процестер үшін энтропия өзгерістерін есептеу
- •4.3.1 Қайтымды изотермиялық процестер үшін
- •4.3.3 Идеалды газ энтропиясының өзгеруі.
- •4.3.4 Қайтымсыз процестер үшін
- •4.4 I және II термодинамиканың заңдарының біріккен теңдеуі
- •4.5 Энтропияның статистикалық мазмұны
- •4.6 Гельмгольцтың және Гиббстың бос энергиялары
- •4.7 Фазалық өзгерістер үшін термодинамиканың II заңын қолдану
- •Электрохимия. Электролиз. Гальваникалық элемент. Металдардың кернеу қатары. Коррозия
- •Комплексті қосылыстар
Электролиттік диссоциация
ХІХ ғасырдың аяғында швед ғалымы Сванте Аррениус электролиттік диссоциация теориясын ұсынды.
Судағы ерітiндiлерi немесе балқымалары иондарға ыдырайтын және электр тоғын өткiзетiн заттарды электролиттер деп атайды.
Иондарға толық ыдырайтын электролиттердi күштi электролиттер деп, жартылай ыдырайтын электролиттердi орташа немесе әлсiз электролиттер деп атайды.
Күштi электролиттер ерітiндiлерiнде тек иондар болады, молекулалар болмайды.
Әлсiз электролиттердiң ерітiндiсiнде иондармен бiрге молекулалар да болады.
H2SO4 H++HSO4-
HSO4- H++SO42-
Ва(OH)2 ВаOH++OH-
ВаOH+ Ва2++OH-
Электролит
күшiн ток өткiзгiштiгiне қарап анықтайды:
![]()
v – заттың берілген сұйылту кезіндегі эквиваленттік электрөткізгіштігі;
- заттың шексіз сұйылту (V) кезіндегі электрөткізгіштігі.
Диссоциациялану
дәрежесі:
![]()
n- иондарға ыдыраған молекулалар саны;
N- жалпы ерітілген молекулалар саны.
-ны сандық үлеспен немесе пайызбен көрсетуге болады. Шексіз cұйылту кезінде 1 немесе 100% болады.
Егер алынған 100 молекуланың 80-ні иондарға ыдыраса, онда бұл электролиттің диссоциациялану дәрежесі 80% болғаны.
Әлсіз электролиттердің тепе-теңдік константасы Кт-т н/се диссоциациялану константасы Кд:
Н2СО3 Н++НСО3-1 ( 1 сатысы).
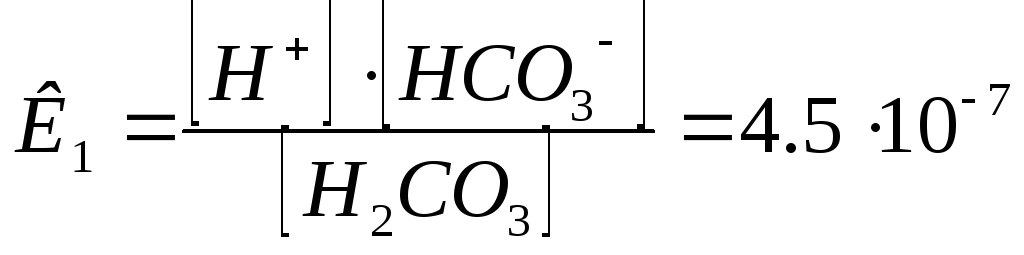
HCO3- H++CO3-2
 (2
сатысы)
(2
сатысы)
Кд неғұрлым аз болса, электролит соғұрлым әлсіз болады.
Тұнбаға түсетін электролиттер, яғни аз еритін қосылыстар үшін басқа өлшем бірлігі қолданылады, ол ерігіштік көбейтіндісі ЕК деп аталады, мысалы:
AgCl Ag++Cl-
![]()
ЕК=Ag+·Cl-. «ЕК» және «Кд» кесетеде беріледі.
Күшті
электролит ерітіндісіндегі күйін, нақты
әрекетін, соған сәйкес ерітіндінің
қасиеттеріне әсерін анықтау үшін
иондардың активтік концентрациясы
қолданылады:![]() аион
=сион
. fион
аион
=сион
. fион
аион –ионның активтілігі;
сион - ион концентрациясы;
fион - активтілік коэффициенті.
Активтілік коэффициенті ерітіндінің иондық күшімен де анықталады. Ол Дебай-Гюккель формуласымен беріледі.
![]()
![]() J1/2
J1/2
![]() -ионның
орташа активтілік коэффициенті;
-ионның
орташа активтілік коэффициенті;
![]() -катион,
анион заряды;
-катион,
анион заряды;
J –ерітіндінің иондық күші.
Қайтымсыз реакциялардың бірнеше жағдайлары бар.
1. Әлсіз электролит – су түзілуі, бейтараптану реакциялары:
2NaOH+H2SO4 = Na2SO4+2H2O
2Na++2OH-+2H++SO4-2 = 2Na++SO4-2+2H2O. Кд=1,810-16
2OH-+2H+ = 2H2O
2. Әлсіз қышқылды күшті қышқылмен ығыстыру:
K2CO3+2HCl = 2KCl+H2CO3. Кд =4,510-7
2K++CO3-2+2H++2Cl- = 2K++2Cl-+H2CO3
CO3-2+2H+ = H2CO3-
3. Әлсіз негізді күшті негізбен ығыстыру:
CuSO4+2KOH = Cu(OH)2+K2SO4
Cu+2+SO4-2+2K++2OH- = Cu(OH)2+2K++SO4-2
ЕК =2,210-20
Cu+2+2OH- = Cu(OH)2
4. Реакциядан шығып кететін газ күйіндегі заттардың түзілуі:
(NH4)2S+2HBr = 2NH4Br +H2S(г). Кд1=8,910-8
2NH4++S-2+2H++2Br- = 2NH4++2Br- +H2S
S-2+2H+ = H2S
5. Қиын еритін тұз тұнбаларының түзілуі:
BaCl2+Na2SO4 = BaSO4+2NaCl
ЕК = 1,110-10
Ba+2+2Cl-+2Na++SO4-2 = BaSO4+2Na++2Cl-
Ba+2+SO4-2 = BaSO4
$$$ 61
Электролиттік диссоциация дегеніміз:
А) бөлек атомдарға электролиттің бөліну процесі;
В) иондар мен атомдар түзілу процесі;
С) иондардың молекулаларға қосылу процесі;
D) заттың бөлек молекулаларға өзіндік ыдырауы;
Е) балқу немесе суда еріту кезінде заттардың иондарға ыдырау процесі.
Е) байланыс энергиясы.
$$$ 84
Ион алмасу реакция аяғына дейін өтеді егер ... әрекеттессе.
А) AI(NO3)3 және KCI;
B) CuSO4 және Zn(NO3)2;
C) NaCI және LiNO3;
D) HCI және Na2CO3;
E) KOH және NaOH.
$$$ 237
Mg(OH)2 үшін иондық көбейтіндісі неге тең?
A) [Mg2+][OH-];
B) [Mg2+]2[OH-];
C) [Mg2+][OH-]2;
D) [Mg2+]+[OH-];
E) [Mg2+]+[OH-]2.
$$$ 90
6,8 г күкіртсутектің көлемін анықтаңыз (қ.ж.).
А) 1,2 л;
В) 2,4 л;
С) 3,2л;
D) 5,6л;
Е) 4,48л.
$$$ 96
0,25н NaOH ерiтiндiсiнiң титрiн (г/мл) анықтаңыз.
А) 0,01;
В) 0,02;
С) 0,03;
D) 0,5;
Е) 1,0.
$$$ 97
Әлсiз электролиттi көрсетiңiз:
А) HNO3;
В) NaOH;
С) Al(OH)3;
D) Na2SO4;
Е) KCl.
$$$ 98
Құрамында 8 г затпен 100 г диэтил эфир бар ерітінді 36,860С-да, ал таза эфир 35,600С-да қайнайды. Еріген заттың молекулалық массасын анықтаңыз. Е(эфир)=2,020.
А) 128,2 г/моль;
В) 345 г/моль;
С) 67 г/моль;
D) 57,9 г/моль;
Е) 158 г/моль.
$$$ 99
Натрий ортофосфаты толық диссоциацияланғанда түзiлетiн ион саны:
А) 2;
В) 3;
С) 4;
D) 6;
Е) 5.
