
Канке В.А., Лукашина Л.В. Концепция современного естествознания Теория и практика
.pdf3. Земля образовалась:
а) в результате излучения Солнцем потока элементарных частиц; б) из газо-пылевого облака; в) из вакуума; г) из Мирового океана.
4. Астеносфера:
а) совпадает с литосферой; б) является частью педосферы; в) является частью мантии;
г) является частью литографических плит.
Литература
1.Вернадский, В. И. Несколько слов о ноосфере // Успехи современной биологии. — 1944. — № 18. — Вып. 2. — С. 113—120.
2.Добровольский, Г. В. Педосфера — оболочка жизни планеты Земля // Междисциплинарный научный и прикладной журнал «Биосфера». — 2009. — Т. 1. —
№1. — С. 6—14.
3.Пущаровский, Д. Ю., Пущаровский, Ю. М. Состав и строение мантии Земли // Соровский образовательный журнал. — 1988. — № 1. — С. 111—119.
4.Сорохтин, Н. О., Сорохтин, О. Г., Чилингар, Дж. В. Теория развития Земли: происхождение, эволюция и трагическое будущее. — Москва; Ижевск: Ин-т компьютерных исследований, 2010.
5.Фролов, В. Т. Наука геология: философский анализ. — М. : Изд-во МГУ, 2004.
6.Хаин, В. Е., Рябухин, А. Г., Наймарк, А. А. История и методология геологических наук. — М. : Академия, 2008.
7.Хаин, В. Е. Основные вехи в истории Земли // Современное естествознание: Энциклопедия : в 10 т. — М. : Магистр-Пресс, 2000. — Т. 9. — Науки о земле. — С. 296—306.
8.Ярошевский, А. А. Химический и минеральный состав вещества Солнечной системы и оболочек Земли // Современное естествознание: Энциклопедия : в 10 т. — М. : Магистр-Пресс, 2000. — Т. 9. — Науки о земле. — С. 36—37.

Глава 5 ХИМИЧЕСКИЕ КОНЦЕПЦИИ
Основная цель данной главы состоит в обеспечении понимания студентом концептуального устройства современной химии. В результате изучения данной главы студент будет:
знать
•концептуальное устройство классической, релятивистской и квантовой механики, а также квантовой теории поля;
•основные концепты, в частности принципы, законы и переменные, различных химических теорий;
•историю развития научного химического знания от Дальтона до наших дней;
уметь
•объяснять в основных чертах динамику химических процессов;
•интерпретировать содержание менее развитой теории с позиций более развитой концепции;
•выявлять связи между принципами, законами и переменными;
владеть
•навыками анализа концептуального содержания химических концепций;
•умением выявлять проблемные аспекты различных воззрений;
•способностью учета междисциплинарных связей химии.
Ключевые термины: квантовая химия, электронные конфигурации атомов, химическая связь, потенциальная поверхность, реакционная способность вещества, органический синтез.
5.1. Основные концептуальные революции в химии
Химия занимает достойное место среди современных наук. По числу публикаций химики превосходят ученых любой специальности. В наши дни под химией, как правило, понимают вполне определенную отрасль науки, которая наряду с физикой, геологией и биологией входит в состав естествознания. Мы обращаемся к химии после анализа физики, космологии и наук о Земле. Это объясняется следующим обстоятельством. Химические элементы возникают во Вселенной лишь на этапе нуклеосинтеза в звездах. К этому времени уже существуют звезды. Таким образом, указанные элементы, если учитывать подчеркиваемую нами историческую первоочередность, должны рассматриваться после космологии. На стадии образования планет они уже существуют. Поэтому было целесообразно предварить рассуждения наук о Земле очерком о химии. Мы не стали делать этого постольку, поскольку рассмотрение истории Солнца вынудило нас тут же перейти к наукам о Земле.
202
Этимология слова «химия»
Этимология слова «химия» вынуждает вспомнить древних египтян и греков, равно как средневековых арабов. Слово «химия» обозначало у египтян — землю (черную, по определению), у греков — технику литья металлов, у арабов — технику добывания золота. Далеко не сразу термин «химия» стали использовать для обозначения одной из наук.
В книгах, посвященных химии, как правило, спешат дать определение химии, исходя из определенного представления об ее предмете. Широко известное клише гласит, что химия является наукой о веществах, их составе, строении, свойствах и взаимных превращениях. На первый взгляд, такое определение вполне состоятельно, поскольку оно выражает общие черты существующих на сегодняшний день химических наук. Сторонники рассматриваемой точки зрения считают чем-то само собой разумеющимся многоходовую операцию, включающую выделение предмета целого ряда химических наук, например неорганической, органической, аналитической, квантовой химии, затем определение общих черт спектра предметов и обозначение его посредством термина «вещество». Но это лишь первое представление. Стоит лишь задуматься над смыслом термина «вещество», как сразу возникнет множество трудных для понимания моментов, связанных
вчастности с концептуальным устройством квантовых представлений,
врамках которых рассматриваемый термин считается спорным.
На наш взгляд, химия является наукой, статус которой определяется принципами, законами и переменными, входящими в состав химических теорий. При желании можно назвать эти концепты, например принцип наименьшего действия, закон кратных отношений, понятие валентности.
Знакомя читателя с новой отраслью науки, авторы книг всегда находятся
втрудной ситуации: следует сказать о многом, но кратко, причем так, чтобы достаточно наглядно представить специфику этой отрасли науки. В этой связи резонно обратиться к концептуальным революциям в химии. По определению, как раз они представляют самое значимое и специфическое в той или иной науке. Но относительно списка концептуальных революций
вхимии у исследователей нет согласия. Нам не остается ничего другого, как представить один из вариантов вычленения научных революций в химии.
Становление химии как науки затянулось на многие века. В подтверждение этой мысли сошлемся на показательный факт. В Античности при построении химических концепций исходили из учения Аристотеля о четырех элементах — земле, воздухе, огне и воде. Через тысячу лет алхимики также руководствовались учением о четрех элементах. Ясно, что античные и средневековые представления не достигали уровня науки. Лишь в Новое время, т.е. начиная с XVII в., химия, занимая видное место в составе научного прогресса, стала превращаться в науку. Обратила на себя внимание установка Р. Бойля (1661) на актуальность экспериментального метода
вхимии как способа борьбы со схоластикой. Однако его успехи, относящиеся непосредственно к химической теории, оказались не очень значимыми.
Лишь в конце XVIII в. наметился существенный концептуальный прорыв. Г. Кавендиш открывает водород (1766), а Дж. Пристли (1774) — кислород. Эти открытия нашли дальнейшее развитие в трудах француза А. Лаву-
203
азье, который дал правильное объяснение процессам горения, окисления и дыхания, опровергнув несостоятельную теорию флогистона. Достигнутый успех был столь значительным, что именно его, автора знаменитого учебника химии (1783), часто называют основателем научной химии. С этим не согласны исследователи, отсчитывающие начало научной химии от трудов Дж. Дальтона (1808). В их позиции есть рациональное зерно.
Дело в том, что Лавуазье скептически относился к концепции атомов, существование которых мол не подтверждено экспериментами. Сейчас любой школьник знает, что химия изучает атомы и молекулы. Трудно переоценить значение Дж. Дальтона в деле развития атомно-молекуляр- ного строения вещества. Более 200 лет назад (1808) Дальтон сформулировал основные положения химической атомистики.
•Химические элементы состоят из мельчайших частиц, называемых атомами.
•Все атомы данного элемента идентичны друг другу.
•Атомы различных элементов различаются по их относительным весам.
•Атомы элементов могут объединяться, образуя соединения.
•Закон кратных отношений: если два вещества образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
•В процессе химических реакций атомы не могут быть созданы, разделены на части или разрушены; химическая реакция приводит к образованию новой комбинации атомов.
Главная заслуга Дальтона состояла в предложении химическому сообществу добротно скомпонованной теории. Именно в этом отношении он превзошел своих современников. Итак, присоединимся к точке зрения тех авторов, которые считают основателем научной химии Дальтона.
Вместе с Дальтоном мы вступили в XIX в. Он ознаменовался многочисленными достижениями, из которых мы выделим два, представляющихся нам особенно значимыми. Это, во-первых, открытие Д. И. Менделеевым периодической таблицы химических элементов (1869). Ему после 20 лет упорной работы удалось обобщить огромный массив экспериментальных данных. По всеобщему признанию, таблица Менделеева наиболее органичным образом представляет фундаментальные основания химии.
Исключительно высокой оценки заслуживают также новации американца Дж. Гиббса в области химической термодинамики (1876—1878). Он развил понятие химического потенциала и свободной энергии, определил энергетическое содержание химических реакций, в том числе возможность их функционирования и осуществления. Благодаря исследованиям Гиббса теоретический потенциал химии был существенно преумножен.
Но даже несмотря на успехи химической термодинамики вплоть до 1930-х гг. химия оставалась феноменологической теорией. Мы имеем
ввиду, что не была известна динамика химических процессов. Непонятно было, почему именно реакции происходят так, а не иначе, а химические элементы демонстрируют периодически повторяющиеся свойства. Новые
204
прозрения наступили лишь после создания квантовой механики и использования ее результатов в химии. В этой связи в 1930—1960 гг. была создана квантовая химия. Она стала результатом усилий многих десятков выдающихся химиков, но, пожалуй, самыми яркими среди них были американцы Л. К. Полинг (Нобелевская премия по химии за 1954 г. — «за изучение природы химической связи и его применение к объяснению строения сложных молекул») и Р. С. Малликен (Нобелевкая премия по химии за 1966 г. — «за фундаментальные исследования природы химических связей и электронного строения молекул на основе метода молекулярных орбиталей»).
Развитие квантовой химии потребовало использования исключительно развитых математических и компьютерных моделей. В этой связи была развита компьютерная химия (ее часто называют также теоретической, или математической, химией). Представителями компьютерной химии являются лауреаты Нобелевской премии по химии за 2013 г., М. Карплюс, М. Левитт и А. Уоршел, с формулировкой: «За развитие многомасштабных моделей комплексных химических систем».
Подведем итоги нашего экскурса в область истории развития химического знания в форме табл. 5.1.
|
|
Таблица 5.1 |
Основные концептуальные революции в химии |
||
|
|
|
Авторы |
Годы |
Главные достижения |
Дж. Дальтон |
1808 |
Основание научной химии в форме атомистиче- |
|
|
ского учения |
Д. И. Менделеев |
1869 |
Создание периодической таблицы химических |
|
|
элементов |
Дж. Гиббс |
1876—1878 |
Развитие химической термодинамики |
Л. К. Полинг, |
1930—1960 |
Развитие квантовой химии |
Р. С. Малликен |
|
|
М. Карплюс, |
1960—2010 |
Развитие компьютерной химии |
М. Левитт, |
|
|
А. Уоршел |
|
|
Выводы
•Химия — отрасль науки с только ей присущими принципами, законами и понятиями.
•Химическое знание известно с незапамятных времен, но лишь в начале XIX в. оно приобрело статус науки.
•На протяжении всего XIX в. химия оставалась феноменологической наукой, ибо не была ясна динамика происходящих процессов.
•Химия стала динамической наукой в XX столетии благодаря развитию квантовой химии.
5.2. Основания квантовой химии
Атом химического элемента состоит из ядра и электронов. В состав ядра входят протоны и нейтроны. Число протонов равно атомному номеру
205
химического элемента в таблице Менделеева. Пропорция между числом нейтронов и протонов увеличивается по мере перехода от легких ядер
кболее тяжелым. Для легких ядер она составляет около 1:1, для тяжелых — 1,6:1. Число электронов в нейтральном атоме равно числу протонов. Как известно, важнейшими характеристиками элементарных частиц являются массы и заряды. Масса протона больше массы электрона в 1836 раз. А это означает, что масса ядер всех атомов химических элементов значительно больше масс электронов, также принадлежащих атому. В силу этого они слабо реагируют на силы притяжения, исходящие от электронов. Упрощая ситуацию, можно сказать, что электроны движутся вокруг ядер атомов.
Итак, применительно к массе существует явное отличие между относительно массивными ядрами атомов и значительно более легкими электронами. Крайне существенно, однако, что по величине электрического заряда электроны не уступают ядрам атомов. В электрическом отношении легкий электрон ни в чем не уступает значительно более тяжелому протону. Электромагнитные силы, действующие между положительно заряженным ядром и отрицательно заряженными электронами, способны обеспечивать устойчивость атомов химических элементов. Объяснить это обстоятельство с позиций классической (неквантовой) механики невозможно. Действительно, в соответствии с ее содержанием электрон, попав в окружение ядра, неминуемо должен столкнуться с ним, инициировав аннигиляцию заряда. Квантовая же механика позволяет объяснить устойчивость атомов химических элементов. Желающему понять устройство химии как науки непременно следует исходить из квантовой химии.
Весьма вероятно, читатель не знаком с квантовой химией. Нам придется сделать попытку ввести его в курс дела. Сделать это непросто. Сложный математический аппарат квантовой механики доступен лишь специалистам. Тем не менее хотя бы краткое объяснение возможно без обращения
кним. Мы постараемся воспользоваться этим обстоятельством.
Для начала отметим, что, разъясняя существо квантового подхода, до некоторой степени можно воспользоваться классическим знанием. Это касается в частности понимания динамики процессов. В классической механике она объясняется действием сил, которые выступают в форме отрицательного градиента потенциальной энергии, т.е. ее уменьшения. Это означает, что тот или иной объект переходит из состояния с большей потенциальной энергией в состояние с меньшей величиной этой же энергии. Это положение является общим для классической и квантовой механики. Реализуя его, объект оказывается в положении с наименьшей потенциальной энергией. Согласно классической механике, объект будет находиться в состоянии равновесия то тех пор, пока какая-либо внешняя сила не выведет его из этого состояния. Согласно квантовой механике, объект никогда не достигнет абсолютно устойчивого состояния: с некоторой долей вероятности он способен перейти даже из положения с наименьшей энергией в состояние с большей энергией. Совсем не обязательно такое перемещение является результатом какого-то внешнего импульса. Итак, подобно положению дел в классической механике, в квантовой механике сохраняется актуальность энергетических параметров. Выполняется закон
206
сохранения полной энергии замкнутой системы, а динамика процессов вызывается изменениями потенциальной энергии. Это обстоятельство имеет решающее значение для понимания динамики всех тех процессов, в том числе химических реакций, с которыми имеет дело химия.
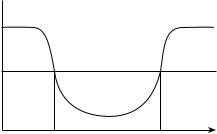
Если в распоряжении химика имеется график потенциальной энергии интересующих его объектов, то он сумеет воспроизвести ход процессов с указанием их динамических истоков. Без этого нет подлинного понимания химических процессов. Обратимся в этой связи к потенциальной энергии, представленному на рис. 5.1.
V 
V(x)
E
x1 |
x2 |
x |
Рис. 5.1. Потенциальная яма
Частица, оказавшаяся в положении между х1 и х2 и обладающая кинетической энергией E, согласно классической механике, не способна преодолеть барьер, задаваемый наибольшим значением потенциальной энергии V.
На рис. 5.1. использовано всего одно пространственное измерение — х. Реальные же частицы, например электроны, имеют три пространственных измерения. С их учетом значения потенциальной энергии лежат на поверхности трехмерного образования, называемого потенциальной поверхностью. «Сама по себе эта поверхность имеет достаточно сложный вид. Однако для нас существенно лишь то, что на этой поверхности имеются различной глубины ямы и соответствующие им минимумы, имеются долины, подходящие к этим ямам, имеются разделяющие эти ямы барьеры или возвышающиеся между долинами гряды и холмы, а кое-где и перевалы, соответствующие путям с наименьшей энергией перехода из одной ямы в другую. Наиболее устойчивые, стабильные конфигурации ядер отвечают минимумам (дну ям), т.е. они представляют собой конфигурации с минимальной электронной энергией: как только мы отходим от такой конфигурации, потенциальная энергия ядер возрастает». Мы привели цитату из научно-популярной статьи профессора Н. Ф. Степанова. Она очень хорошо выражает основную идею динамической химии: динамика химических процессов определяется,
впервую очередь, потенциальной энергией взаимодействующих объектов.
Всилу исключительной актуальности понятия концептуальной ямы рассмотрим участь частицы, угодившей в нее. Ширина ямы равна L, внутри ямы потенциальная энергия равна нулю, а вне ее — бесконечности. Для этого случая движение частицы описывается одномерным стационарным уравнением Шрёдингера в следующей форме:
207
d2 |
|
8 2mE |
0. |
(5.1) |
|
õd 2 |
2 |
||||
|
|
|
Согласно решению этого уравнения, частица обладает набором дискретных значений кинетической энергии:
En |
2 |
2 |
n2 |
, |
(5.2) |
|
2mL2 |
||||||
|
|
|
|
|||
где n 1, 2, 3, ….
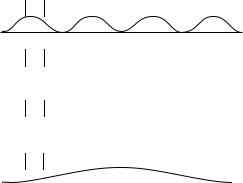
Для каждого n волновая функция является особой, о чем свидетельствует рис. 5.2.
4 2
n 4 |
E 16E0 |
3 2
n 3  E 9E0
E 9E0
2 2
n 2  E 4E0
E 4E0
1 2
n 1 |
|
E E0 |
|
Рис. 5.2. Плотности вероятности обнаружения частицы в различных
квантовых состояниях
Вполне возможно, что уравнение Шрёдингера для читателя непонятно. Мы осмелились записать его с единственной целью, а именно убедить читателя в том, что если вероятность значений различных параметров ведет себя волновым образом, то неминуемо появляется дискретность. А это и есть фирменный знак квантовой механики, в том числе квантовой химии. Природа частицы является таковой, что многие ее параметры принимают только дискретные значения.
Обратите внимание, что при n 1, частица с наибольшей вероятностью будет обнаружена посредине отрезка L, при n 2 вероятность обнаружения
вэтом месте частицы близка к нулю. При n 3 частица с наибольшей вероятностью будет обнаружена в трех местах. При n 1000 она с наибольшей вероятностью будет посещать столько же мест. Столь странное, с позиций классической физики, поведение квантовой частицы вынуждает отказаться от понятия орбиты движения частицы. Вместо нее вводится понятие орбитали. Орбиталь — это пространственно-временное представление частицы
всоответствии с содержанием уравнения Шрёдингера. При этом сама частица не является точечным образованием. Классическая частица имеет вполне определенные размеры. Квантовая же частица обладает многими
208
размерами, но с различной степенью вероятности. Вспомним соотношение неопределенности для импульса и координаты частицы, движущейся по оси х (см. параграф 2.7).
x px |
|
. |
(5.3) |
|
2 |
||||
|
|
|
Оно указывает на необычное обстоятельство, рассуждая о размерах квантового объекта, непременно необходимо иметь в виду и его импульс (p). Допустим, мы стали бы рассуждать об электроне, который упал на ядро атома. В таком случае х было бы очень маленьким, а p, наоборот, очень большим. Электрон бы обладал столь большой кинетической энергией, что он преодолел бы силы притяжения ядра. Описанный феномен позволяет понять, почему захват ядром атома электрона маловероятен. Он оказывается возможным лишь в случае, если наряду с электромагнитными силами в захвате будут участвовать также слабые взаимодействия. В таком случае протон, поглощая электрон, превращается в нейтрон. Атомный номер элемента понижается на одну единицу. Итак, согласно квантовой механике, при соответствующих условиях электромагнитное взаимодействие положительно заряженного ядра и отрицательно заряженных электронов с большой долей вероятности обеспечивает устойчивое существование атомов.
Выводы
•Динамика химических процессов объясняется квантовой механикой посредством понятия потенциальной поверхности. Причиной этих процессов является отрицательный градиент потенциальной энергии.
•Потенциальные барьеры преодолеваются частицей либо спонтанно (туннельный эффект), либо под воздействием других частиц.
•Частица, находящаяся в потенциальной яме, обладает набором дискретных значений энергии.
•Каждому энергетическому уровню энергии соответствует особая волновая функция.
•Орбиталью называется пространственно-временной образ частицы, в соответствии с уравнением Шрёдингера.
5.3. Структура электронных конфигураций атомов
Состояние электрона в атоме задается не только главным квантовым числом n, рассмотренном в предыдущем параграфе, но еще тремя квантовыми числами, а именно l, ml и ms. Дело в том, что важнейшими характеристиками электрона являются орбитальный момент (Ml), орбитальный магнитный момент (Mlz) и спиновый момент (Msz). И все три пропорциональны постоянной Планка ( ):
M 2 |
l(1 1) 2; M |
lz |
m ; M |
sz |
m . |
(5.4) |
l |
|
1 |
s |
|
Коэффициенты пропорциональности n, l, ml и ms называются квантовыми числами. Разумеется, всегда следует учитывать, что они стоят при
209
соответствующих параметрах. Орбитальный момент указывает на подвижный характер электронной орбитали. Электрон не есть всего лишь неподвижная точка. Орбитальный магнитный момент указывает на еще одно обстоятельство: в качестве подвижной относительно ядра атома частицы, обладающей отрицательным зарядом, электрон является магнитом. Но электрон обладает также и собственным магнитным моментом (спином), наличие которого подтверждено экспериментально. Его природа пока никак не объясняется.
Что касается возможных значений квантовых чисел, то они представлены в табл. 5.2.
|
|
|
|
Таблица 5.2 |
|
Квантовые числа |
|
||
|
|
|
|
|
Название |
Символ |
Возможные |
Примеры значений |
|
|
|
|
значения |
|
|
|
|
|
|
Главное число |
N |
1 |
n |
n 1, 2, 3, … |
|
|
|
|
|
Азимутальное число |
|
0 |
l n –1 |
Для n 4: l 0, 1, 2 (s, p, d) |
|
|
|
|
|
Магнитное (азимутальное) |
ml |
–l ml l |
Для l 2: ml –2, —1, 0, 1, 2 |
|
число |
|
|
|
|
Спиновое число |
ms |
–1/2, +1/2 |
+1/2 |
|
Главное квантовое число n задает номер уровня и, соответственно, число подуровней, которое может быть большим, например равным 1000. Но для невозбужденных атомов оно не превышает число 7. Главное число характеризует энергию уровня и средний радиус атомных орбиталей. Чем выше n, тем энергия электрона больше, а электронная оболочка расположена дальше от ядра атома.
Азимутальное число l характеризует энергию подуровня, которая зависит от орбитального момента. Оно также характеризует тип подуровня, который, по историческим основаниям, задается маленькими латинскими буквами s(l 0), p(l 1), d(l 2), f(l 3), g(l 4) и т.д.
В теории показывается, что для любого l имеется 2l + 1 атомных орбиталей, которые все обладают одинаковой энергией и переходят в друг друга при соответствующих поворотах. Если l 0, то 2l + 1 1. Это означает, что при поворотах форма атомной орбитали не изменяется. Этому условию соответствует форма сферы. Следовательно, форма s-атомной орбитали является сферической. Если l 1, то 2l + 1 3. Три формы p-атомной орбитали таковы, что они переходят друг в друга, причем ведут себя так же, как координаты х, у, z. Этому условию соответствует двухлепестковая форма. Если l 2, то 2l + 1 5. Поэтому d-атомные орбитали имеют 5 форм. Все описанные нами формы представлены на рис. 5.3 (не беда, если читателю непонятны некоторые математические члены, используемые для описания орбиталей. Важно усвоить главное — что атомные орбитали, соответствующие определенному значению l, обладают некоторыми группами симметрии).
210
