
Канке В.А., Лукашина Л.В. Концепция современного естествознания Теория и практика
.pdf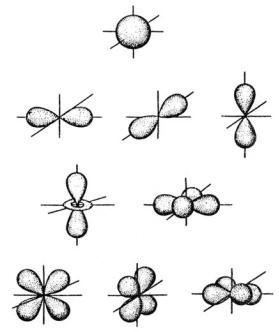
|
|
|
|
|
y |
|
|
|
|
|
|
x |
|
|
|
|
s |
|
|
z |
|
z |
|
y |
z |
y |
y |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
x |
|
x |
x |
|
px |
z |
|
py |
|
|
|
|
|
|
z |
pz |
|
|
|
|
|
|
||
|
|
|
y |
|
|
y |
|
|
|
|
|
|
|
|
|
|
x |
|
|
x |
|
|
|
|
|
dz2 y2 |
|
z |
|
dz2 |
z |
|
|
z |
|
|
y |
|
|
|
y |
|
|
|
|
|
x |
|
|
|
x |
|
|
x |
|
dxz |
|
|
dyz |
|
|
dxy |
|
|
|
|
|
Рис. 5.3. Формы s-, p-, d-атомных орбиталей
Магнитное число характеризует число атомных орбиталей и их ориентацию в магнитном поле атома. Спиновое число характеризует непосредственно индивидуальность электрона. Его часто изображают в форме маленьких вертикальных стрелочек. Направление отдельно взятого спина может быть любым, но если оно выбрано, то направление антагонистического спина будет противоположным. После всего сказанного становится понятной структура электронных уровней. Она представлена в табл. 5.3.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.3 |
||
|
Структура электронных уровней |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Главное квантовое |
1 |
2 |
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
||
число n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Максимальное число |
2 |
8 |
|
|
18 |
|
|
32 |
|
|
|
50 |
|
|
|||
электронов на энер- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гетическом уровне: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хn = 2n2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Орбитальное число l |
0 |
0 |
|
1 |
0 |
1 |
2 |
0 |
1 |
|
2 |
3 |
0 |
1 |
2 |
3 |
4 |
Символ подуровня |
1s |
2s |
|
2p |
3s |
3p |
3d |
4s |
4p |
|
4d |
4f |
5s |
5p |
5d |
5f |
5g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Максимальное число |
2 |
2 |
|
6 |
2 |
6 |
10 |
2 |
6 |
|
10 |
14 |
2 |
6 |
10 |
14 |
18 |
электронов на поду- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ровне: Хl 2 (2l + 1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
211
Читателю нетрудно убедиться в правильности формул Хl 2(2l + 1) и Хn 2n 2. Первая из этих формул правильна постольку, поскольку при данном l магнитное квантовое число принимает 2l + 1 значений. Но к тому же следует учитывать, что каждому этому значению соответствует два спина. В результате получается формула Хl 2(2l + 1). Сумма всех Xl, относящихся к данному n, дает n 2.
Выводы
•Орбитальный момент (Ml), орбитальный магнитный момент (Mlz) и спиновый момент (Msz) кратны постоянной Планка ( ).
•Атомные орбитали, соответствующие определенному значению l, обладают некоторыми группами симметрии.
•Максимальное число электронов, относящихся к одному и тому же энергетическому уровню или подуровню, является вполне определенным, а не произвольным.
5.4. Закономерности заполнения атомных орбиталей
Обратимся теперь к вопросу о закономерностях заполнения атомных орбиталей. Решающее значение, как обычно, имеют энергетические характеристики. В этой связи учитываются три принципа.
•Принцип минимума энергии. В невозбужденном атоме электроны распределяются по энергетическим уровням и подуровням так, чтобы их суммарная энергия была бы минимальной. В рамках указанного принципа справедливо правило В. М. Клечковского: энергия электрона тем меньше, чем меньше сумма n + l; при равенстве этой суммы для двух или нескольких электронов энергия меньше у тех электронов, у которых меньше главное квантовое число n.
•Принцип Паули. В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. В этой связи особенно существенно, что на каждой орбитали не может быть двух электронов с одинаковыми спи-
нами. Допускается электронное заполнение , но не или .
• Принцип Гунда. Заполнение орбитали начинается электронами с одинаково направленными спинами; лишь после того, как именно этими электронами заполнены все вакансии, наступает черед электронов с противоположными спинами.
В табл. 5.4 приведены структурная и процессуальная форма электронных энергетических подуровней. Числа, стоящие на месте степеней показательных функций, указывают максимальное число электронов, способных занять данный подуровень.
Таблица 5.4
Сравнение двух форм электронных подуровней
Структурная форма энер- |
1s 2; 2s 2; 2p 6; 3s 2; 3p 6; 3d 10; 4s 2; 4p 6; 4d 10; 4f 14; 5s 2; 5p |
гетических подуровней |
6; 5d 10; 5f 14; 5g 18; 6s 2; 6p 6; 6d 10; 6f 14; 6g 18 |
Последовательность |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 |
заполнения энергетиче- |
4d105p6 6s2 4f145d106p6 7s2 5f14 6d10 6p6 |
ских подуровней |
|
212
Втабл. 5.4 в последней строке показана последовательность заполнения энергетических подуровней. Известная неожиданность состоит в том, что она не совпадает с той последовательностью заполнения, которая должна быть, согласно 4-й строке в табл. 5.3. Там 3d стоит после 3p, а не после 4s. Соответственно, выделенные нами полужирным шрифтом энергетические подуровни вроде бы стоят не на своих местах. Это впечатление ошибочное. Дело в том, что первая строка табл. 5.4 не выражает последовательность заполнения энергетических подуровней. В ней они перечислены таким образом, что нарушается принцип минимума энергии, который следует заметить, является следствием принципа наименьшего действия. Строгое следование ему как раз и приводит к той последовательности заполнения энергетических подуровней, которая указана в последней строке табл. 5.4.
После всего сказанного в качестве иллюстрации закономерностей квантовой механики мы приводим таблицу Менделеева в том ее виде, который рекомендуется Международным союзом прикладной и теоретической химии — IUPAC, 2011 (табл. 5.5).
Втабл. 5.5 химические элементы сгруппированы в 18 групп (по вертикали) и в семь периодов (по горизонтали насчитывается семь строк). Замечательная особенность рассматриваемой таблицы состоит в том, что
вней выделяются четыре блока. В s-блок входят все элементы первых двух групп и гелий (He). Это означает, что самый внешний электрон относится к s-подуровню. В p-блок входят все элементы, входящие в группы (3—12), за исключением лантаноидов (атомные номера элементов с 57 по 71) и актиноидов (атомные номера 89—103), образующих f-блок. p-блок образуют элементы 13—18 групп (за исключением гелия). Блочная принадлежность того или иного элемента позволяет судить о его валентности, т.е. о важнейшей характеристике атомов химических элементов.
На основании таблицы Менделеева достаточно просто выразить электронную конфигурацию любого атома. Действительно, его номер задает число электронов. Как и в каком количестве они распределяются по энергетическим подуровням, известно (см. последнюю строку табл. 5.3). Допустим, что нас заинтересовал атом кальция Ca. Его номер 20, следовательно, всего у него 20 электронов. Нетрудно установить, на каких энергетических подуровнях они расположены. Запишем общую формулу заполнения энергетических подуровней.
1s 2 2s 2 2p 6 3s 2 3p 64s 2.
В случае кальция нас интересует та стадия заполнения энергетических подуровней, при которой достигается число 20. В рассматриваемом случае это уровень 4s, ибо именно на нем сумма числа электронов достигает числ 20 (2+2+6+2+6+2 20). Полная электронная формула невозбужденного атома кальция будет выглядеть следующим образом (знак не пишется):
20Са: 1s 22s 22p 63s 23p 64s 2.
Таблица Менделеева содержит в концентрированном виде огромный объем сведений, которые излагаются в тысячах книг. Жанр нашей книги позволяет перечислить лишь некоторые из них.
213

214
Таблица 5.5
Система элементов Менделеева
1 18
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
H |
2 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
He |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
4 |
|
|
|
|
|
|
|
|
|
|
5 |
6 |
7 |
8 |
9 |
10 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
Na |
Mg |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Al |
Si |
P |
S |
Cl |
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
56 |
57- |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
TI |
Pb |
Bi |
Po |
At |
Rn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
87 |
88 |
89- |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
|
114 |
|
116 |
|
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
|
Fi |
|
Lv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лантаноиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Актиноиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
|
||
|
|
|
|||||||||||||||
|
|
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Td |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
89 |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
|
|
|
Аc |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•Масса атомов при перемещении по таблице сверху вниз и слева направо возрастает.
•Радиус атомов при перемещении по таблице сверху вниз увеличивается, но убывает по мере перемещения слева направо.
•Электроотрицательность при перемещении по таблице сверху вниз убывает, но увеличивается слева направо.
•Энергия ионизации при перемещении по таблице сверху вниз убывает, но возрастает слева направо. Металличность увеличивается при перемещении по таблице сверху вниз, но убывает слева направо.
Напоследок обратимся к вопросу о количестве химических элементов, достойных быть включенными в таблицу Менделеева. Свинец является химическим элементом с наибольшим атомным номером, существующим
вформе стабильных, нерадиоктивных изотопов. Все элементы с номерами выше 82 не обладают стабильными изотопами. То же самое характерно и для технеция (номер 43) и прометия (номер 61). Таким образом, атомы только 80 химических элементов являются стабильными. Что касается радиоактивных элементов, то, как показывает практика экспериментальных исследований, обнаружить их в естественных условиях затруднительно. Из экспериментально известных 118 химических элементов только 98 были обнаружены в естественных условиях. Еще 20 элементов было синтезировано. Не исключается, что расширение экспериментальных возможностей приведет к резкому возрастанию числа радиоактивных химических элементов. Их существование предсказывается в рамках многих теорий, в частности теории сверхновых звезд.
Выводы
•В невозбужденном атоме электроны распределяются по энергетическим уровням и подуровням так, чтобы их суммарная энергия была минимальной.
•В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
•Современная интерпретация основного содержания таблицы Менделеева предполагает выделение групп, периодов и блоков химических элементов.
•Множится число синтезируемых радиоактивных химических элементов.
5.5. Химическая связь
До сих пор мы в основном ограничивались рассмотрением атомов. Не учитывалось, что они находятся в системе чрезвычайно многообразной системы химических взаимодействий, которые характерны для атомов и молекул, равно как всевозможных ассоциатов, существующих в частности в форме твердых тел. Для всех химических объектов, состоящих из некоторых частей, важнейшей характеристикой является химическая связь. Ее наиболее часто характеризуют посредством той энергии, которая выделяется, при разрушении химического объекта.
Химическая связь — это тот химический параметр, который обеспечивает единство химического объекта. Выражаясь более конкретно, можно сказать, что химическая связь — это энергия связи или же силы, действу-
215
ющие между частями атома или молекулы. Она может быть представлена как в силовом, так и в энергетическом выражении. Наиболее часто используется энергетическое представление, которое более органично сопрягается с квантово-механическими представлениями, чем понятие силы. Впрочем, понятие силы имеет также сильные стороны, в частности оно очень наглядно. Химическая связь имеет место там, где взаимодействующие агенты удерживаются вместе некоторыми силами.
Теоретической базой объяснения химических связей является квантовая механика. В рамках классической химии последовательное объяснение природы химической связи невозможно. Если же обратиться непосредственно к квантовой химии, то придется иметь дело с двумя конкурирующими теориями, а именно теорией валентных связей и теорией молекулярных орбиталей.
В теории валентных связей полагают, что процесс взаимодействия атомов находит непосредственное проявление в объединении внешних для атомов орбиталей. Эта гибридизация приводит к тому, что возникает молекулярная орбиталь, которая «стягивает» воедино атомы, входящие в состав молекулы. Такая химическая связь называется ковалентной. Приставка ко- означает в данном случае, что валентные электроны стали общими для атомов. Число электронов на молекулярной орбитали в случае невозбужденных молекул определяется законом минимума полной энергии молекулы, но в наиболее типичном случае приходится рассматривать одну или нескольких пар электронов.
Формирование ковалентной связи происходит посредством двух механизмов — обменного и донорно-акцепторного. В случае обменного механизма объединяются орбитали вместе с находящимися на них неспаренными электронами. В случае донорно-акцепторного механизма атом-донор поставляет электроны, а атом-акцептор — свободную орбиталь. Различие двух механизмов образования ковалентной связи иллюстрирует рис. 5.4.
A B A B
A B A B
Рис. 5.4. Формирование ковалентной связи
Втеории молекулярных орбиталей молекула рассматривается как целое,
ане как совокупность сохранивших индивидуальность атомов. Стратегия теоретического анализа далее совпадает со способом рассмотрения атомов. В молекуле имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы. По аналогии с атомными s-, p-, d-,
f-орбиталями молекулярные орбитали обозначают греческими буквами -,-, -, -.
В развитие теории валентных связей, с одной стороны, и теории молекулярных орбиталей, с другой стороны, внесли значительный вклад многие ученые, но наибольших успехов в развитии первой теории достиг Л. Полинг, а второй — Р. Малликен. В период 1930—1960 гг. две рассма-
216

триваемые теории считались чуть ли не противоположностями. В дальнейшем, однако, выяснилось, что они дополняют друг друга. При анализе относительно простых молекул хорошо подходит теория валентных связей. Но при анализе сложных молекулярных комплексов эффективнее теория молекулярных орбиталей. По степени универсальности она явно превосходит теорию валентных связей. Именно в этой связи выяснилось, что понятие валентности, под которой обычно понимается способность атомов к образованию определенного числа ковалентных связей, подходит для характеристики далеко не всех химических систем.
Наряду с ковалентной часто рассматривают также ионную и металлическую химическую связь. Для ионной связи характерно сильное взаимодействие электронной пары с ядром только того атома, который обладает большей способностью притягивать к себе электронные пары (эта способность называется электроотрицательностью).
A B A B A [ B]
Рис. 5.5. Ионная химическая связь
На рис. 5.5 отчетливо просматривается родственность ковалентной и ионной химической связи. В рассматриваемом контексте само введение представления о положительно и отрицательно заряженных ионах не вполне правомерно. Электронная пара, по определению, принадлежит как атому А, так и атому B, поэтому неправильно относить ее исключительно к B. Во избежание недоразумений в выражении «ионная химическая связь» термин «ионная» следовало бы брать в кавычки.
Характерной чертой металлической связи является взаимодействие положительных ионов металлов, составляющих кристаллическую решетку,
сэлектронным газом. Химики не отказываются от различения ковалентной, ионной и металлической связи. Это оказывается возможным постольку, поскольку ковалентная связь в таком случае понимается как связь, для которой не выражены ярко характеристики ионной и металлической связи.
Наряду с химическими связями, фирменным знаком которых является образование обобщенных электронов, существуют межмолекулярные связи, вызываемые силами Ван-дер-Ваальса. Эти силы обычно связаны
собразованием диполей и поляризацией молекул. Все они реализуют особый тип химической связи. Еще одним типом химической связи является водородная связь. Было установлено, что некоторые водородсодержащие группы атомов часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такая связь получила название водородной. Ее часто изображают в следующей форме: A — H ··· B (чертой обозначается ковалентная связь, а тремя точками водородная).
Химические связи характеризуются энергией связи, радиусами и углами. Как правило, энергия ковалентной связи значительно превосходит энергию межмолекулярных связей. Но это правило имеет много исключений. В области межмолекулярных взаимодействий энергетическими чемпио-
217
нами выступают ион-ионные взаимодействия. Энергия их взаимодействия составляет от 160—400 кДж/моль против 6—132 кДж/моль в случае водородных связей. Приведем несколько ковалентной связи для широко распространенных химических элементов. Как свидетельствует содержание табл. 5.6, чем больше энергия связи между атомами, тем меньше расстояние между ними.
|
|
|
Таблица 5.6 |
|
Энергия и диаметр ковалентных связей |
||
|
|
|
|
Связь |
|
Энергия связи (в кДж/моль) |
Диаметр в (10–12 м) |
H H |
|
436 |
74 |
C C |
|
348 |
154 |
C C |
|
614 |
134 |
|
|
|
|
C C |
|
839 |
120 |
|
|
|
|
N N |
|
163 |
146 |
|
|
|
|
N N |
|
418 |
125 |
|
|
|
|
N N |
|
945 |
110 |
O O |
|
146 |
148 |
O O |
|
498 |
121 |
|
|
|
|
Выводы
•Химическая связь — это энергия связи атомов молекулы. Она обеспечивается взаимодействием электронов, находящихся на молекулярных орбиталях, с ядрами атомов.
•Различают ковалентные (в узком смысле этого слова), ионные и металлические химические связи.
5.6. Динамика химической реакции
Проведенный в предыдущем параграфе анализ феномена химической связи позволяет перейти к рассмотрению химических реакций, основного объекта химии. Химическая реакция представляет собой преобразование молекул-реагентов в молекулы-продукты. Оно возможно лишь в случае, если реорганизуются химические связи, т.е. происходит разрыв старых и образование хотя бы одной новой химической связи, т.е. имеет место элементарный химический акт. Как правило, вся химическая реакция, заканчивающаяся образованием молекул продуктов, включает множество элементарных химических актов. Если их число больше единицы, то образованию конечных продуктов предшествует переходный комплекс. Он в своей заключительной стадии в силу отсутствия химической связи неустойчив и, следовательно, не является подлинным химическим соединением. Таким образом, химическая реакция представляет собой последовательность по крайней мере трех переходов: а) молекулы-реагенты переходный комплекс; б) последовательность совокупности элементарных
218
химически актов в составе переходного комплекса; в) переходный комплекс продукты реакции.
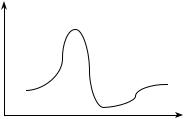
Естественно, химические реакции представляют для ученых первостепенный интерес. Они стремятся детально освоиться с ними. Но что именно это означает? Исчерпывающее химическое объяснение предполагает прежде всего постижение динамических сторон химических реакций, вызывающих к жизни соответствующую кинематику, например скорость осуществления реакций. Решающие подступы к химической динамике открыла квантовая химия. Руководствуясь ее понятиями, химики строят для каждого химического соединения многомерную потенциальную поверхность (см. параграф 5.2). Применительно к каждой химической реакции сопрягаются потенциальные поверхности исходных и конечных продуктов. Минимумы поверхности соответствуют устойчивым конфигурациям ядер, т.е. реагентам и продуктам, максимумы (перевалы) — переходным состояниям. Та или иная химическая реакция выступает как переход от одного энергетического минимума к другому (рис. 5.6).
Переходное Потенциальная состояние
энергия
Реагенты
Продукты
Координата реакции
Рис. 5.6. Химическая реакция
Объяснение химической реакции как перемещения по потенциальной поверхности ее агентов, которую мы представили в двухмерном виде, является динамическим. Обращаясь к энергетическим характеристикам, можно объяснить как подъем на перевал, который может осуществляться за счет подведения, например, тепловой энергии, так и спуск с него, происходящий по большей части спонтанно. Тем не менее указанное объяснение при всех его достоинствах обладает также и недостатками. Один из них и, пожалуй, самый существенный состоит в том, что весьма скромно используются кван- тово-полевые представления. Фотоны часто фигурируют в качестве источников энергий, но при этом не используется аппарат квантовой теории поля. Задействовать его в полной мере для объяснения химических систем, состоящих из огромного числа частиц, пока не удается. Это задача на будущее.
Другой недостаток приведенного энергетического объяснения химической реакции состоит в его недостаточной детальности. Иначе говоря, не представлен его механизм, причем в виде, позволяющем действительно выразить характерные для молекул особенности. Масштаб этих изменений определяется длительностями колебаний ядер атомов и простейших химических реакций. Речь идет о промежутках времени порядка 10–13—10–14 сек. Если доступные химикам-экспериментаторам длительности больше
219
указанных величин, то динамика химических процессов не получает своего адекватного выражения. Доступ к химической динамике оказался связанным с освоением масштабов микровремени. Этот процесс растянулся на целый век, вплоть до 1990-х гг. В табл. 5.7 представлены способы мониторинга хода химических реакций.
|
Таблица 5.7 |
Мониторинг длительностей химических преобразований |
|
Доступные |
Способ мониторинга |
длительности (с) |
|
105—102 |
Отбор и контроль проб |
102–10–4 |
Методы быстрого турбулентного смешения в газе или жидко- |
|
сти потоков реагентов |
10–4—10–8 |
Создание молекулярных пучков |
10–8—10–11 |
Лазерные технологии |
10–12—10–15 |
Современные лазеры |
Решающий успех оказался связанным с достижениями фемтосекундной спекроскопии, развитой египетско-американским химиком А. Зевейлом (Нобелевская премия по химии за 1999 г.). Он изучал молекулы посредством лазерных импульсов длительностью в десятки фемтосекунд (1фс 10–15 с), надеясь последовательно зафиксировать все стадии переходного состояния. Как и следовало ожидать, результаты исследования оказались довольно неожиданными. Выяснилось, что перераспределение ядер молекул происходило на фоне их не прекращающихся когерентных колебаний. Имел место процесс перестройки, а не грубого разрыва химических связей.
Исследования Зейвала показали возможность управления динамикой химических реакций. Воздействуя на ядра атомов лазерными импульсами, можно переводить их на желаемые участки потенциальных поверхностей. Фемтосекундные методы активно используются в деле изучения и управления микроэлектронными и микробиологическими процессами.
Разумеется, химики стремятся добиться дальнейших успехов в деле постижения химического микровремени. Теперь они мечтают о достижении масштабов аттосекунд (1 аттосекунда 10–18 с). Оно позволит наблюдать за движением не только ядер атомов, но и отдельных электронов. Впрочем, сугубо экспериментальные методы не всесильны. Непосредственно в эксперименте можно наблюдать смешанные, но не чистые и запутанные состояния электронов. Лишь вместе с теоретическими методами эксперимент позволяет представить динамику химических реакций в выверенном виде.
Выводы
•В процессе химических реакций происходит перестройка химических связей.
•Минимумы потенциальных поверхностей соответствуют устойчивым конфигурациям атомов, т.е. реагентам и продуктам, максимумы (перевалы) — переходным состояниям.
•Решающий успех в изучении химической динамики обеспечили фемтосекундные методы.
220
