
Канке В.А., Лукашина Л.В. Концепция современного естествознания Теория и практика
.pdf
5.7. Типы химических реакций
Во всякой науке вопросы, связанные с классификацией основных феноменов, занимают центральное место. Это положение относится в полной мере к химии, в частности в связи с необходимостью выделения типов химических реакций (табл. 5.8).
Таблица 5.8
Типы химических реакций
Классификаци- |
Типы химических реак- |
Пояснения |
|
онные |
ций |
|
|
признаки |
|
|
|
По конечному |
Реакции присоединения |
AB+C ABC |
|
результату |
|
|
|
Реакции отщепления |
ABC AB+C |
||
|
|||
|
|
|
|
|
Реакции замещения |
AB+C AC +B |
|
|
|
|
|
|
Реакции перегруппи- |
ABC ACB |
|
|
ровки |
|
|
|
|
|
|
По тепловому |
Экзотермические реакции |
Тепло выделяется |
|
эффекту |
|
|
|
Эндотерические реакции |
Тепло поглощается |
||
|
|||
|
|
|
|
По фазовому |
Гомогенные реакции |
Между реагентами отсутствует |
|
составу |
|
поверхность раздела |
|
|
|
|
|
|
Гетерогенные реакции |
Взаимодействие происходит |
|
|
|
на поверхности раздела |
|
По признаку |
Обратимые реакции |
Реакции, протекающие в реагирую- |
|
обратимости |
|
щей системе в состоянии химического |
|
|
|
равновесия с равными скоростями |
|
|
|
в двух противоположных направле- |
|
|
|
ниях |
|
|
|
|
|
|
Необратимые реакции |
Реакции, не являющиеся обратимыми |
|
|
|
|
|
По типу |
Ионнообменные реакции |
A+B– + C+D– A+ D–+ C+B– |
|
переносимых |
|
|
|
Кислотно-основные |
|
||
частиц |
H A : B BH A |
||
|
реакции |
Ионы водорода переносятся от донора |
|
|
|
||
|
|
к акцептору водорода |
|
|
|
|
|
|
Реакции комплексообра- |
M : L [M : ] |
|
|
зования |
||
|
|
||
|
|
|
|
|
Окислительно-востанови- |
Восстановитель отдает электроны, т.е. |
|
|
тельные реакции |
окисляется; окислитель присоединяет |
|
|
|
электроны, т.е. восстанавливается |
|
|
|
|
|
По механизму |
Гомолитические |
A : B A· + B· |
|
расщепления |
(свободнорадикальные) |
Электронная пара, осуществляющая |
|
связи |
Реакции |
связь, разделяется между образующи- |
|
|
|
мися фрагментами (радикалами) |
|
|
|
|
221

|
|
Окончание табл. 5.8 |
Классификаци- |
Типы химических реак- |
Пояснения |
онные |
ций |
|
признаки |
|
|
|
Гетеролитические |
A : B A B |
|
Реакции |
|
|
(случай полного гетеролиза; и — соот- |
|
|
|
|
|
|
ветственно частично положительный |
|
|
и частично отрицательные заряды; |
|
|
образующиеся при разрыве поляризо- |
|
|
ванной ковалентной связи). |
|
|
Электронная пара в отличие от поло- |
|
|
жения дел в гомолитической реакции |
|
|
не разделяется |
По механизму |
Простые |
Одностадийная реакция |
взаимодей- |
Сложные (последователь- |
Многостадийные реакции |
ствия |
ные, последовательно- |
|
|
параллельные, цикличе- |
|
|
ские, цепные) |
|
Приведенная классификация химических реакций весьма приблизительная. Не следует думать, что она задает некоторую незыблемую структуру,
вкоторую можно вставлять любую химическую реакцию. Мир химических реакций, в который погружен человек, чрезвычайно многообразен, он не поддается единственно верной однозначной классификации. Но необходимо также учитывать, что научный анализ в отсутствие классификации вообще не может состояться. Ученый классифицирует, постоянно осознавая, что уже завтра ему придется модифицировать свои выводы. Это обстоятельство особенно отчетливо проявляется в органической химии. Здесь многие необычные химические реакции называются именами их первооткрывателей. Именных органических реакций насчитывается не менее тысячи. И все они отмечены печатью своеобразия. Добавим к этому, что число известных органических и неорганичеких соединений исчисляется в десятках миллионов, причем
внеделю оно прирастает не меньше, чем на 50 тыс. единиц. Для характеристики многообразия химических соединений весьма показателен такой факт:
триаконтан (С30H62) может иметь 4111846763 структурных изомера с таким числом атомов. А ведь он составляет ничтожно малую часть углеводородов Вселенной. Как бы то ни было, мир химических явлений демонстрирует удивительную гармонию. Познать ее — задача химического сообщества.
Выводы
•Классифицируя химические реакции, их разделяют на типы в соответствии
снекоторыми критериями. Таких критериев может быть достаточно много. В табл. 5.8 использовано семь критериев.
•В химической литературе часто основными типами химических реакций считаются реакции присоединения, отщепления, замещения и перегруппировки.
•Огромное многообразие химических реакций не поддается однозначной классификации, которая поэтому постоянно совершенствуется.
•Многообразие мира химических соединений и реакций не исключает их закономерного устройства.
222
5.8.Химическая термодинамика
Впараграфе 2.20 рассматривалась термодинамика. Там же отмечалась закономерная взаимозависимость параметров энергии, температуры
иэнтропии. В химии термодинамика приобретает черты, характерные именно для химических процессов. В этой связи вводится ряд понятий, которые будут рассмотрены ниже. Химическая термодинамика — это наука о зависимости направления химических реакций и пределов их превращений в зависимости от условий, в которых находятся вещества. Замечательная особенность химической термодинамики состоит в том, что целый ряд актуальных выводов можно получить, не используя представления о строении вещества и механизмах происходящих внутри него процессов. Это означает, что ее выводы имеют довольно общий характер. Было бы неверно сводить всю химию к таким выводам, но в их актуальности не приходится сомневаться. В науке часто стремятся получить выводы при минимуме исходных данных. Такого рода ситуация весьма характерна для химической термодинамики, которая наряду с учением о строении вещества и химической кинетики является частью физической химии.
Чтобы выразить специфику химической термодинамики, для начала обратимся к первому началу термодинамики, согласно которому изменение количества теплоты (ΔQ) связано с изменением внутренней энергии (ΔU) соотношением
Q U + W, |
(5.5) |
где W — совершаемая работа. Большинство химических реакций проходит в изобарных условиях, т.е. давление является неизменным. Обычно оно равно 1 атмосфере. С учетом этих обстоятельств уравнение (5.5) можно записать следующим образом:
Q U + p V+We, |
(5.6) |
где p V — работа, произведенная в связи с изменением объема реагентов, а We — немеханическая работа, производимая, например, электромагнитными силами в гальванических элементах. Для большинства изобарных процессов We 0. С учетом этого обстоятельства перепишем уравнение (5.6) следующим образом:
Q Q2 – Q1 U2 – U1 – pV1 (U2 + pV2) – |
|
– (U1 + pV1) H2 – H1 H, |
(5.7) |
где H U + pV называется энтальпией. Ее химический смысл состоит в том, что она характеризует энергетическое состояние химической реакции в изобарных условиях. Если химическая реакция является экзотермической, т.е. сопровождается выделением тепловой энергии, то H2 > H1, следовательно, H > 0. В случае эндотермической ситуации H < 0.
Согласно закону русского химика Г. И. Гесса, открытого им в далеком 1840 г., энтальпия реакции, имеющей место в изобарно-изотермиче- ских или изохорно-изотермических условиях, зависит только от природы
223
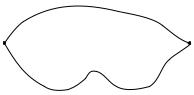
и состояния исходных и конечных веществ, но не от пути ее протекания. Этот закон иллюстрируется рис. 5.7.
Н1
Ai |
Bi |
Н2
Рис. 5.7. Закон Гесса (ΔH1 H2)
Энтальпия — величина аддитивная, т.е. для сложной системы она равна сумме энтальпий ее независимых частей. Единицей измерения энтальпии является кДж/моль. Стандартная энтальпия жидкой воды составляет — 286 кДж/моль. Это означает, что при стандартных условиях (Т 25, p 1 атм) на образование 18 г воды из составляющих ее вещество атомов водорода и кислорода требуется 286 кДж энергии. Закон Гесса демонстрирует применимость закона сохранения энергии, выражаемого первым началом термодинамики, к энергетике химических реакций.
Выше мы извлекли некоторые химические выводы из первого начала термодинамики. Теперь нам предстоит сделать то же самое со вторым началом термодинамики, согласно которому в изолированных макроскопических системах, т.е. при отсутствии обмена энергией и веществом с окружающей энергией, энтропия S либо возрастает, либо остается без изменения. Одного этого положения недостаточно для определения направленности хода химической реакции. Необходимо учитывать также изменение энергии. Но как это сделать? Суть дела впервые выяснил американский химик Дж. У. Гиббс.
Он ввел для характеристики химических реакций в изобарно-изотерми- ческих условиях особую функцию:
G Н – ТS, |
(5.8) |
где G — энергия Гиббса (названа в честь ее изобретателя). С учетом постоянства температуры перепишем уравнение (5.8) в следующем виде:
H G + T S. |
(5.9) |
Из этого выражения следует, что часть количества теплоты расходуется на увеличение энтропии S. Эта часть энергии теряется, она не определяет ход реакции. Другое дело G, именно эта характеристика определяет ход химической реакции. Если G G2 – G1 < 0, то реакция возможна. При G > 0 она невозможна. Равенство G 0 характеризует химическое равновесие. В соответствии с уравнением (5.9) термодинамическая разрешимость или же неразрешимость химической реакции определяется вкладом
энтальпийной и энтропийной составляющих (табл. 5.9).
224
|
|
|
Таблица 5.9 |
|
Условия термодинамической возможности реакций |
||
|
|
|
|
|
H, S |
G |
Термодинамическая возможность реакции |
|
|
|
|
H < 0, |
S >0 |
G < 0 |
Возможна |
|
|
|
|
H > 0, |
S < 0 |
G > 0 |
Невозможна |
|
|
|
|
H < 0, |
S < 0 |
G < 0 |
Возможна (при низких температурах) |
|
|
|
|
|
|
G > 0 |
Невозможна |
|
|
|
|
H > 0, |
S >0 |
G < 0 |
Возможна (при высоких температурах) |
|
|
G > 0 |
Невозможна |
|
|
|
|
Что касается третьего начала термодинамики, согласно которому при абсолютной температуре T, равной нулю, и энтропия равна нулю, то и оно используется в химической термодинамике. В частности, изучается нетривиальная ситуация, связанная с тем, что при низких температурах знак G определяется исключительно знаком H. Это обстоятельство имеет существенное значение для криогенной химии.
Таким образом, все три начала физической термодинамики находят в химии свою дальнейшую спецификацию. В этой связи непременно следует отметить, что химики, вводя те или иные ограничения, например уделяя особое внимание изобарно-изотермическим процессам, не ограничиваются ими. При дальнейших уточнениях некогда введенные ограничения снимаются и вводятся новые, например рассматривается изменение термодинамических функций с ростом и понижением температур реагентов. И тогда они в очередной раз убеждаются, что концептуальный аппарат химической термодинамики позволяет ориентироваться в сложном мире химических явлений. И тут же выясняется, что выводы химической термодинамики недостаточны. Они непременно должны дополняться концептуальными достижениями других химических наук, в частности, химической кинетики.
Выводы
•Закон Гесса наиболее органично выражает закон сохранения энергии применительно к химическим реакциям.
•Важнейшее значение для химии имеют понятия энтальпии и энергии Гиббса.
•Специфику второго начала термодинамики применительно к химическим реакциям наиболее органично выражает изменение энергии Гиббса, величина которого определяет возможность и невозможность химической реакции и химического равновесия.
5.9. Реакционная способность веществ и скорость химической реакции
Хорошо известно, что реакционная способность веществ варьируется в широких пределах. Все взрывчатые вещества обладают высокой реакционной способностью. Некоторые реакции, характерные, например, для геологических явлений, растягиваются на миллионы лет. Реакции между
225
молекулами протекают обычно медленнее, чем между ионами. Химически пассивны благородные металлы, например золото, и инертные газы,
вчастности гелий. На их фоне щелочные металлы, например литий, обладают высокой активностью. Для всесторонней характеристики реакционных способностей веществ химикам пришлось ввести целый ряд понятий, среди которых главнейшими являются «химический потенциал», «химическая активность» и «скорость химической реакции».
Химический потенциал представляет собой энергию, добавляемую
вхимическую систему одной частицей без совершения работы. Этой энергией является в случае постоянства: энтропии и объема — внутренняя
энергия, энтропии и давления — энтальпия, температуры и объема — энергия Гельмгольца (F U + pV), температуры и давления — энергия Гиббса. Читатель, очевидно, не удивлен тем обстоятельством, что реакционные способности химических веществ определяются в первую очередь их энергетическими параметрами. Эта характерная особенность веществ неоднократно обсуждалась на протяжении всей данной главы.
На основе понятия химического потенциала определяется понятие активности химических веществ (а):
|
|
i |
0 |
|
|
|
|
a exp |
|
i |
|
, |
(5.10) |
||
|
|
|
|||||
i |
|
RT |
|
|
|
||
|
|
|
|||||
где μi — химический потенциал при данных условиях, 0i — потенциал для условий принятых стандартными (часто это условия чистого компонента), Т — температура, R — газовая постоянная.
Как следует из формулы (5.10), при определении реакционных способностей веществ дополнительно к энергетическим характеристикам следует учитывать в качестве одного из ее факторов температуру.
Химический потенциал и активность являются динамическими характеристиками реакционной способности вещества. Разумеется, они приводят к определенной кинетике. В этой связи решающее значение имеет скорость химических реакций, которая является основным предметом изучения химической кинетики. Таким образом, скорость химической реакции является основной кинетической характеристикой реакционной способности вещества. Она понимается как изменение концентрации реагирующих веществ за секунду.
Согласно основному уравнению химической кинетики скорость реакции (v) пропорциональна концентрации (c) реагентов (A, B, …):
v k(A)(B), |
(5.11) |
где k — постоянная скорости, nA — порядок реакции по реагенту А, nB — порядок реакции по реагенту В.
Порядок реакции по реагенту равен показателю степени, в которую следует возвести концентрацию данного реагента. Он определяется экспериментальным путем и в достаточно простых случаях принимает значения 0 (реакция нулевого порядка), 1 (реакция первого порядка), 2 (реакция вто-
226
рого порядка). Но его значения необязательно являются целочисленными, к тому же они могут быть и отрицательными.
Величину k называют постоянной скорости. В действительности же она не является постоянной, а зависит от многих факторов, в частности от температуры. Она не зависит только от концентрации реагентов, ибо их значение учитывается не величиной k, а другими членами кинетического уравнения. Скорость химической реакции зависит от концентрации реагентов, а постоянная реакции от этой концентрации не зависит.
Скорость химической реакции, а следовательно, и реакционная способность веществ зависят от многих факторов, главные из них указаны в табл. 5.10.
|
Таблица 5.10 |
Факторы, влияющие на скорость химической реакции |
|
|
|
Факторы |
Характер влияния |
|
|
Концентрация |
Чем выше концентрация, тем больше скорость реакция. Дело |
|
в том, что с ростом концентрации увеличивается число элемен- |
|
тарных химических актов |
Температура |
Чем выше температура, тем больше скорость реакции. Объ- |
|
ясняется это тем, что увеличивается число контактов частиц, |
|
многие из которых обладают необходимой энергией актива- |
|
ции. Согласно правилу Вант-Гоффа, в интервале температур |
|
от 0 до 100 оС при увеличении температуры на 10 оС скорость |
|
реакции увеличивается в 2—4 раза. Это правило имеет много |
|
исключений |
Давление |
Чем выше давление, тем больше скорость реакции. Ведь рост |
|
давления приводит к повышению концентрации. Впрочем, этот |
|
эффект в основном характерен для газов и в значительно мень- |
|
шей степени для жидкостей и твердых тел |
Природа реагиру- |
Ионнообменные и кислотно-основные реакции, как правило, |
ющих веществ |
идут значительно быстрее, чем реакции комплексообразования |
Агрегатное состо- |
В твердых телах реакции происходят медленнее, чем в жидких |
яние вещества |
и газообразных. Скорость реакции также зависит от степени |
|
однородности или, наоборот, неоднородности реагентов. Пере- |
|
мешивание, как правило, повышает скорость реакции |
Катализатор |
Увеличивает скорость химических реакций. Основной эффект |
|
достигается за счет снижения энергии активации. По определе- |
|
нию, катализатор остается химически неизменным. В биохими- |
|
ческих реакциях роль катализаторов играют ферменты |
Ингибитор |
Уменьшает скорость реакций, остается химически неизменным |
|
|
Свойства раство- |
Как правило, растворитель способствует росту скорости реак- |
рителя |
ции. Особенно это характерно для полярных растворителей, т.е. |
|
растворителей, обладающих электрическим дипольным момен- |
|
том |
Различные типы |
Как правило, ускоряют ход реакций |
излучений |
|
227
Мы рассмотрели динамические и кинетические аспекты реакционных способностей химических веществ. Во избежание недоразумений следует отметить, что понятие «реакционные способности вещества» не является устоявшимся в химии. Выражение, взятое нами в кавычки, широко используется, но оно не определяется в качестве такого параметра, который фигурировал бы в химических формулах. Нет такого единообразного параметра, в соответствии со значением которого можно было бы установить иерархию всех химических веществ. Из сказанного, на наш взгляд, не следует вывод, что нельзя использовать выражение «реакционные способности вещества». Вряд ли химическое сообщество откажется от этого выражения. По нашему мнению, реакционная способность вещества представляет собой комплекс характеристик, среди которых наиважнейшими являются в динамическом отношении энергия Гиббса, а в кинетическом отношении — скорость химической реакции.
Выводы
•Для всесторонней характеристики реакционных способностей веществ химикам пришлось изобрести целый ряд понятий, среди которых главнейшими являются «химический потенциал», «химическая активность» и «скорость химической реакции».
•Важнейшей кинетической характеристикой является скорость химической реакции. Она зависит от многих факторов.
5.10. Органический синтез и катализ
Этот параграф посвящен органической химии и ее главной современной составляющей — органическому синтезу. Процесс органического синтеза в большинстве случаев ускоряется за счет использования катализаторов. Объектом органической химии являются соединения углерода (за исключением тех из них, которые изучаются в рамках неорганической химии), их структура, свойства и методы синтеза. Возраст органической химии обычно отсчитывают от 1828 г. В этом году немецкий химик Ф. Вёлер первым получил органическое вещество, мочевину, посредством упаривания водного раствора цианата аммония (NH4OCN). Этот успех позволил расстаться с господствовавшей в начале XIX в. гипотезой, согласно которой природа органических веществ определяется жизненной силой, т.е. биологическими параметрами. Стало ясно, что органическая химия является исконно химической, а не биологической наукой.
Длительное время в органической химии преобладали труды, посвященные структурам и свойствам органических соединений. Но приблизительно в середине XX в. случился прорыв, который в наибольшей степени соответствует нынешнему облику органической химии, в которой центральной темой является синтез новых соединений, обладающих ценными физическими, химическими, биологическими или же техническими свойствами. Биологический синтез, особенно в его каталитическом варианте, стал одним из решающих факторов научно-технического прогресса. В этой связи достаточно вспомнить крекинг нефти.
228
Основателем органического синтеза считается американец Р. Б. Вудворт. Этот гениально одаренный химик синтезировал многие сложные биологические вещества, в частности хинин, кортизон, тетрациклин. За эти достижения он был удостоен в 1965 г. Нобелевской премии по химии. Вудворт был не только блестящим экспериментатором, но и выдающимся методологом. Именно он убедил химическое сообщество в том, что необходимыми условиями успешной деятельности в области органического синтеза является постоянная опора на концептуальные достижения органической химии и тщательное планирование каждого предпринимаемого действия. Это положение — главная парадигма органического синтеза.
Каждая стадия синтеза реализуется в форме вполне определенной химической реакции, происходящей с соответствующими реагентами. Длинными признаются синтезы, состоящие более чем из 20 стадий. Условия проведения реакции должны быть выбраны такими, чтобы они обеспечивали получение максимально эффективного результата при наименьших затратах. Разумеется, должны соблюдаться экологические стандарты и правила безопасности. В табл. 5.11 приводятся некоторые из реакций, часто используемых при органическом синтезе.
|
Таблица 5.11 |
|
Реакции органического синтеза |
|
|
Реакция |
Эффект реакции |
|
|
Гидрирование |
Присоединение водорода по кратной связи |
|
|
Дегидрирование |
Отщепление водорода |
|
|
Гидратация |
Присоединение воды по кратной связи с образованием спирта |
|
|
Дегидратация |
Отщепление воды с образованием кратной связи |
|
|
Алкирирование |
Обмен водорода на углеводородный радикал |
|
|
Ацилирование |
Введение в молекулу остатка карбоновой кислоты |
|
|
Циклизация |
Образование циклической структуры в молекуле |
|
|
Галогенирование |
Введение атома галогена в молекулу посредством обмена |
|
водорода на галоген или присоединения по кратной связи |
Нитрование |
Обмен водорода на группу NO2 |
Этерификация |
Взаимодействие органической кислоты со спиртом с получе- |
|
нием сложных эфиров |
Окисление |
Изменение в молекуле, приводящее к увеличению степени |
|
окисления углерода |
Сульфирование |
Обмен водорода на сульфатную группу |
|
|
Полимеризация |
Образование высокомолекулярного вещества |
|
|
Органический синтез тесно связан с катализом, под которым понимается процесс ускорения химических реакций посредством особых химических веществ, катализаторов. Для катализаторов характерны четыре особенности:
229
1)они не изменяет величину стандартной энергии Гиббса;
2)снижают энергию активации;
3)химически реагируют с исходными веществами, образуя неустойчивый промежуточный продукт;
4)на заключительной стадии реакции восстанавливают свою идентичность.
Органический синтез крайне редко обходится без катализа, не является всего лишь подручным средством. Всякий раз, когда ставится вопрос об инициации некоторого синтеза и путях его осуществления, непременно
вцентр внимания попадает и каталитическая составляющая этого процесса. Разумеется, при этом учитывается, что именно благодаря катализаторам (ферментам) обеспечивается существование биосферы. В живой клетке ферменты (белки), которые катализируют химические процессы, играют фундаментальную роль в процессах обмена веществ, а также в воспроизводстве и транскрипции генетической информации.
Понимание катализа встречается с определенными трудностями, которые Б. В. Романовский выразил в острой проблемной форме: «Каталитические процессы всех типов (гомогенные, гетерогенные и ферментативные) подчиняются одним и тем же фундаментальным законам, однако отсутствие общей теории катализа, способной заранее предсказывать каталитическую активность веществ, дает основания рассматривать катализ скорее как искусство, чем строгую науку. В то же время все недавние успехи молекулярного дизайна в создании функциональных моделей биокатализаторов с заранее заданными свойствами целиком основаны на фундаментальных химических знаниях».
Следует отметить, что многие выдающиеся химики, стремясь адекватно понять существо органического синтеза и катализа, их неординарные черты, добавляют к науке еще и искусство. На наш взгляд, этого не следует делать. Феномен искусства — предмет искусствоведения, а не химии. Органический синтез и катализ представляют собой разделы химии как науки. Да, они необычны, путь их отмечен многочисленными достижениями, но и проблемными аспектами. Наличие последних не выводит химию за пределы науки. Химики с успехом синтезируют наряду с другими химическими веществами и катализаторы, в частности ферменты. Они непременно добьются также решающих успехов в дедуктивном предсказании каталитической активности веществ.
Выводы
•Благодаря развитию химического, особенно органического синтеза химия приобрела инженерную направленность.
•Главная парадигма теории органического синтеза состоит в том, что необходимыми условиями успешной деятельности в области органического синтеза являются постоянная опора на концептуальные достижения органической химии и тщательное планирование каждого предпринимаемого действия.
•Органический синтез и катализ — ведущие направления современной химии. Они имеют научный характер. Трудности, с которыми они встречаются, свидетельствуют об их проблемном характере. Химия была, есть и всегда будет полем высочайшего проблемного напряжения.
230
