
- •Вопрос 1.8
- •Задача 1.19
- •Вопрос 1.19
- •Задача 1.26
- •Вопрос 1.26
- •Задача 2.8
- •Вопрос 2.8
- •Задача 2.19
- •Вопрос 2.19
- •Задача 2.26
- •Вопрос 2.26
- •Задача 3.8
- •Вопрос 3.8.
- •Задача 3.19
- •Вопрос 3.19
- •Задача 3.26
- •Вопрос 3.26
- •Вопрос 4.8
- •Задача 4.19
- •Вопрос 4.20
- •Вопрос 4.26
- •Вопрос 4.31
- •Задача 5.8
- •Вопрос 5.8
- •Задача 5.19
- •Вопрос 5.19
- •Вопрос 5.26
- •Вопрос 5.31
- •Задача 6.8.
- •Вопрос 6.8.
- •Вопрос 6.9
- •Задача 6.26
- •Вопрос 6.26
- •Список использованной литературы
Задача 1.26
3 кг водорода с начальной температурой t1=0°С и абсолютным давлением p1=0,1 МПа нагреваются при постоянном давлении до температуры t2=2000 C. Определить начальный и конечный объем газа, количество подводимого к нему тепла и изменение его энтропии.
Решение
Изобразим данный процесс в pv- и Ts-диаграммах.(Рис. 3,Рис. 4)

Рис. 3

Рис. 4
Считая водород идеальным газом, можем записать для него уравнение состояния.
 (30)
(30)

Процесс изобарный, поэтому
 (31)
(31)
Из уравнения (29) следует
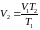 (32)
(32)

Элементарное количество подводимой теплоты определяется из выражения
 (33)
(33)
В нашем случае
 (34)
(34)
Тогда
 (35)
(35)

Изменение энтропии вычисляется по (36)
 (36)
(36)
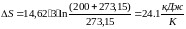
Ответ:
Вопрос 1.26
Как, зная средние теплоемкости от 0 до t°, вычислить среднюю теплоемкость в интервале температур от t1 до t2. Какая из теплоемкостей — от 0 до t1°, от 0 до t2° или от t1 до t2 — будет иметь наибольшее значение и почему? Проиллюстрируйте это на графике.
Ответ:
 (37)
(37)
Теплоемкость зависит от параметров, при которых протекает процесс, например от давления и температуры. Эта зависимость чаще все описывается полиномом:
 (38)
(38)
Либо линейно:
 (39)
(39)
Линейная зависимость с от t изображена на (Рис. 5).

Рис. 5
Также на этом рисунке отмечены
 .
.
Очевидно, что наибольшей будет
 .Это
объясняется тем, что с увеличением
верхнего предела температуры теплоемкость
будет увеличиваться, а с уменьшением
нижнего - уменьшаться.
.Это
объясняется тем, что с увеличением
верхнего предела температуры теплоемкость
будет увеличиваться, а с уменьшением
нижнего - уменьшаться.
Задача 2.8
2 кг метана с начальной температурой t1=400° С с абсолютным давлением p1=0,6 МПа адиабатно расширяются так, что внутренняя энергия его уменьшается на 50 кДж. Определить начальный и конечный удельные объемы газа, а также конечные температуру и давление его. Найти также изменение энтальпии газа.
Решение
Изобразим этот процесс в pv- и Ts – диаграммах (Рис. 6, Рис. 7)

Рис. 6
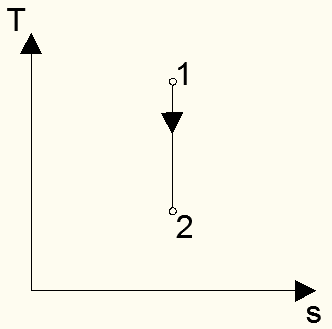
Рис. 7
Из первого закона термодинамики следует, что работа адиабатного процесса идет только на изменение внутренней энергии:
 (40)
(40)
По условию задачи
 50
кДж, из уравнения 38 следует L=
50 кДж.
50
кДж, из уравнения 38 следует L=
50 кДж.
Известно, что
 (41)
(41)
Из(13), (39) получим
 (42)
(42)
Откуда следует
 (43)
(43)
Тогда
 =
657,27К
=
657,27К
Для адиабатного процесса
 (44)
(44)
Из (42) следует
 (45)
(45)
Здесь к – показатель адиабаты. Для метана, поскольку он многоатомный газ, к=1,33
Тогда

Из уравнения Менделеева- Клайперона для одного килограмма газа следует, что
 (46)
(46)
Тогда

Известно, что в адиабатном процессе
 (47)
(47)
Найдем конечный удельный объем газа.

Зависимость между работой и технической работой выражается формулой
 (48)
(48)
Тогда запишем второй закон термодинамики.
 (49)
(49)
Т.к. Q=0, то
 (50)
(50)
Из (48) найдем изменение энтальпии

Ответ:

Вопрос 2.8
Линия какого процесса – адиабатного или изотермического – будет идти круче в pv-диаграмме и почему? За счет чего совершается работа в процессе адиабатного и изотермического расширения?
Ответ
Для нахождения линии изотермического процесса в pv-диаграмме определим производную dp/dv . Запишем уравнение состояния
 (51)
(51)
Из (51) следует
 (52)
(52)
Дифференцирование (52) дает
 (53
(53
С учетом уравнения состояния идеального газа находим
 (54)
(54)
Cотношение (54) указывает, что наклон изотермы в pv-диаграмме всегда отрицателен и возрастает с увеличением давления, т.е. изотерма представляет гиперболу, проходящую слева - направо, сверху - вниз.
Найдем производную dp/dv для адиабатного процесса. Из(51)имеем
 (55)
(55)
Дифференцирование (52) дает
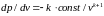 (56)
(56)
С учетом уравнения адиабатного процесса (57)
 (57)
(57)
можно записать
 (58)
(58)
Cотношение (58) указывает на то, что наклон адиабаты в pv-диаграмме, как и для изотермы, всегда отрицателен и возрастает с увеличением давления. Однако адиабата представляет гиперболу более крутую, чем изотерма, поскольку у последней абсолютное значение производной dp/dv в любой точке меньше в k раз, что вытекает из сравнения производных адиабатного и изотермического процесса.
Т.к. ,
то изменение внутренней энергии для
изотермического процесса равно нулю:
,
то изменение внутренней энергии для
изотермического процесса равно нулю:
 (59)
(59)
Запишем первый закон термодинамики для закрытой системы.
 (60)
(60)
Уравнения (59), (60) позволяют записать
 (61)
(61)
Выражение (61) говорит о том, что работа в изотермическом процессе осуществляется полностью за счет теплоты процесса.
Так как в адиабатном процессе dq = 0, то из первого закона термодинамики (60) следует, что работа адиабатного процесса полностью идет на изменение внутренней энергии ТС
dl = - du (62)
Изобразим изотерму и адиабату в pv-диаграмме (Рис. 8)
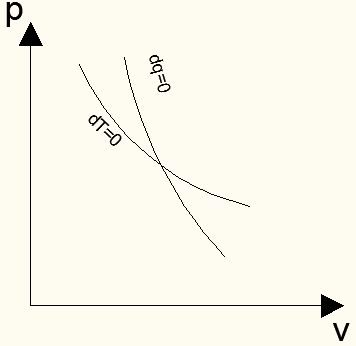
Рис. 8
