
- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
Концентрационная поляризация
Данная поляризация происходит при активном аноде, например, серебряном

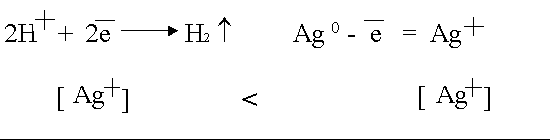 .
.
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители.
Поскольку диффузия в жидкостях медленная, концентрация ионов Ag в анодном пространстве намного выше, чем в катодном. Вследствие этого в электролизере возникает концентрационный гальванический элемент.
ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его.
С концентрационной поляризацией бороться гораздо проще, чем с химической. Ее устраняют перемешиванием раствора.
Перенапряжение электрода
Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами.
Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода.
Перенапряжение водорода велико при следующих условиях:
малых плотностях тока,
низких температурах раствора.
Перенапряжение также зависит от материала катода.
Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода.
Перенапряжение водорода может играть как отрицательную, так и положительную роль.
Отрицательную роль оно играет при необходимости получить водород электролитическим путем.
Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода.
Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия).
Коррозия металлов
Коррозия металлов - разрушение металлов под действием агрессивной окружающей среды.
Виды коррозии:
сплошная;
участками;
питтинг;
межзерновая;
растрескивание;
селективная.
Все виды коррозии одинаково опасны.
По механизмам протекания процесса коррозия подразделяется на химическую и электрохимическую.
Химическая коррозия:
газовая;
жидкостная.
Газовая коррозия происходит под влиянием агрессивных сухих газов.
Жидкостная коррозия вызывается растворами неэлектролитов. Этот вид коррозии очень характерен для продуктов нефтехимии.
Электрохимическая коррозия отличается от химической коррозии тем, что в системе возникает направленный поток электронов, т.е. электрохимическая коррозия возникает там, где присутствуют электролиты.
Электрохимическая коррозия:
гальванокоррозия (аналогична работе гальванического элемента);
электрокоррозия (представляет собой электролиз).
Электрохимическая коррозия гораздо активнее химической коррозии.
Гальванокоррозия
Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.
По соотношению потенциалов алюминий является анодом, медь - катодом.
Рассмотрим данную гальванопару в кислой среде:

Разрушается анод, в данном случае алюминий.
Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу - чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита.
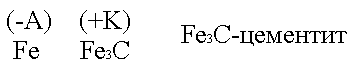
Кристаллы железа играют роль микроанодов, участки цементита - микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О).

Следующей распространённой причиной возникновения гальванокоррозии является аэрация - неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.
Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:

Электрокоррозия - это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются:
весь электротранспорт,
электроаппараты, работающие на земле.
Поток электронов, идущий по рельсу, встречая какое -- либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода.
Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него.
Данный участок трубопровода становится анодом и начинает разрушаться:

Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление.
Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
 или
или
![]() .
.
Защита металлов от коррозии
В результате коррозии металлические изделия разрушаются, причем в таком количестве, что борьба с коррозией необходима.
Способов борьбы с коррозией очень много. Основные способы:
электрозащита;
защитные покрытия, которые подразделяются на металлические и неметаллические;
легирование.
Электрозащита
К электрозащите относятся способы, при которых в системе возникает направленный поток электронов:
катодная защита,
протекторная защита.
Катодная защита
Суть её сводится к следующему: к катоду внешнего источника питания присоединяют защищаемый металл, к аноду - ненужный кусок металла. Пока поступает ток от внешнего источника, анод разрушается, а катод остается в целости и сохранности.
Недостатком этого метода является расход электроэнергии.
Протекторная защита
Суть ее: два металла - защищаемый и протектор - приводятся в тесный контакт. Металл протектора подбирается так, чтобы он оказался анодом по отношению к защищаемому изделию. В первую очередь разрушается анод, защищаемое изделие сохраняется. Данный вид защиты относится к электрозащите, так как в системе возникает направленный поток электронов.
Электрозащита применяется в тех случаях, когда объём окружающей агрессивной среды очень велик. Электрозащита применяется на морских судах (подводные части), для защиты всех подводных и подземных сооружений.
