
- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
Водородный электрод сравнения
Водородный электрод сравнения удобен тем, что стандартный электродный потенциал водорода равен нулю
φ02H+|H2= 0,00В.
Водородный электрод представляет собой сосуд, в котором находится H2SO4 с концентрацией [H+] = 1 моль/л.
Электрод выполняется из платины, которая сверху покрыта слоем рыхлой платины. Платина, особенно рыхлая, является прекрасным адсорбентом газообразного водорода.
Извне в этот сосуд подается газообразный водород под давлением в 1атм. Платиновый электрод поглощает водород и практически становится водородным электродом.
Электроды сравнения необходимы по той причине, что не существует методов непосредственного измерения электродных потенциалов. Возможно только измерение ЭДС гальванического элемента и вычисление неизвестного потенциала по известному.
Электрод сравнения соединяется в гальванический элемент с электродом из того металла, потенциал которого необходимо измерить, (рисунок).
Измерение ЭДС данного гальванического элемента производится компенсационным методом.
Схема включает в себя реохорд, рис.3.
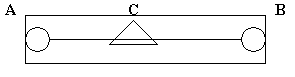
Рис.3
Реохорд - длинная деревянная линейка, по краям которой находятся металлические зажимы, между зажимами туго натянута стальная струна определенного сопротивления. По струне перемещается металлический движок. В схему включены аккумулятор и гальванометр. Движок реохорда перемещают до тех пор, пока стрелка гальванометра не остановится на нуле. Это - состояние компенсации, для которого справедливо соотношение:
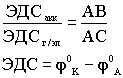 ,
,
где
ЭДСакк- ЭДС аккумулятора,
ЭДСг/эл - ЭДС гальванического элемента,
AB - длина линейки,
AC - расстояние до движка (состояние компенсации).
Концентрационные гальванические элементы
Особенностью концентрационного гальванического элемента, рис.4, является то, что оба электрода выполнены из одного и того же метала.
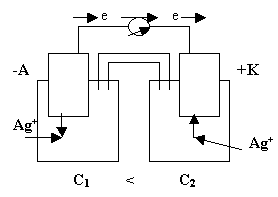
Рис.4
Эти электроды отличаются друг от друга только концентрациями солевых растворов.
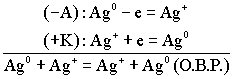
(По формуле Нерста) рассчитаем ЭДС концентрационного элемента.
![]()
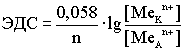
Недостатки концентрационных гальванических элементов:
разрушаемый анод,
малая ЭДС.
Концентрационные элементы используются в тех случаях, где необходима малая ЭДС.
Окислительно - восстановительные (ов) гальванические элементы
Особенностью данных элементов является то, что окислительно - восстановительный процесс протекает только в растворах. Оба электрода являются инертными, или пассивными, т.е. сами они не принимают участия в ОВ процессах, а выполняют роль проводников электронов.
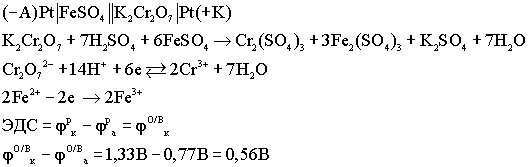
Топливные элементы(тэ)
Электрохимические реакции очень медленные. Для ускорения процессов советский инженер Давтян предложил ввести в окислительно - восстановительные гальванические элементы катализаторы.
Суть топливных элементов заключается в том, что электроды являются одновременно и катализаторами. Топливо, т.е. восстановитель и окислитель, хранится вне гальванических элементов и подаётся на электроды по мере необходимости, рис.5.

Рис.5
Электроды выполняются из пористого Ni или пористой Pt, то есть тех металлов, которые являются катализаторами электродных процессов. В качестве электролита используется раствор гидроксида калия.
Схема кислородно- водородного ТЭ может быть записана в виде:
![]() .
.
На аноде элемента протекает реакция окисления водорода:
![]() .
.
На катоде восстанавливается кислород:
![]() .
.
Суммированием анодной и катодной реакций получаем уравнение токообразующей реакции:
![]() ,
,
в результате которой химическая энергия непосредственно превращается в электрическую.
Пример применения топливных элементов - использование их в мобильниках фирмы Toshiba.
ЭЛЕКТРОЛИЗ
Электролиз - разложение электротоком.
Электролиз - это процесс, обратный процессу, происходящему при работе гальванических элементов.
Электролизом называется превращение электрической энергии в химическую.
Через электролизёр, содержащий расплав или раствор электролита, проходит постоянный ток от внешнего источника питания. В результате на электродах начинают протекать окислительная и восстановительная реакции.
Существует три вида электролиза:
