- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
Закон Вант - Гоффа
Закон Вант - Гоффа определяет величину осмотического давления раствора.
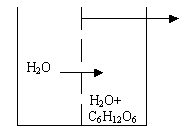
Чтобы ознакомиться с понятием осмоса, рассмотрим сосуд, разделённый на две части полупроницаемой мембраной.
|
Полупроницаемая мембрана - перегородка, через которую проникают молекулы растворителя, но не проходят частицы растворённого вещества. |
Осмос представляет собой самопроизвольное одностороннее перемещение молекул растворителя через полупроницаемую мембрану из той части системы, где концентрация растворителя выше, в ту часть системы, где его концентрация ниже.
Определение осмотического давления растворов производится следующим образом. Во внешний сосуд наливается чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной линейкой. Во внутреннем сосуде находится какой - либо раствор, например, сахара.
В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые стенки будут проходить во внутренний, движение молекул в этом приборе только одностороннее.
Таким образом, объём раствора во внутреннем сосуде увеличивается и поднимается по оттянутой горловине. В результате разницы в уровнях жидкостей во внешнем и внутреннем сосудах в приборе возникает гидростатическое давление. Это давление препятствует осмосу.
Величина гидростатического давления, при которой осмос прекращается, называется осмотическим давлением раствора. (Росмотическое, кПа )
Росмотическое = RTCB кПа, где
R - универсальная газовая постоянная 8,31 Дж/моль, T - абсолютная температура, K, CB - молярная концентрация раствора
Растворы электролитов
Электролиты - вещества, которые в воде диссоциируют на ионы. Существует три класса электролитов:
кислоты
гидроксиды
соли.
Растворы электролитов имеют две особенности по сравнению с растворами неэлектролитов:
проводят электроток,
подчиняются законам Рауля и Вант - Гоффа с определёнными отклонениями.
Обе особенности растворов электролитов объяснила гипотеза шведского учёного Сванте Аррениуса (1883 г).
Гипотеза Аррениуса сводилась к тому, что вещества неидеальных растворов, то - есть то, что сейчас называется растворами электролитов, в воде диссоциируют на ионы.
Поскольку неидеальные растворы проводили электроток, то их называли растворами электролитов.
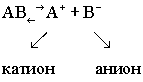
Для растворов электролитов в математические выражения законов Рауля и Вант - Гоффа был введён поправочный коэффициент. Ввёл его Вант - Гофф и назвал его изотоническим коэффициентом.
i - поправочный коэффициент (изотонический коэффициент).
Законы Рауля для растворов электролитов:
ΔP / РА = i NB,
Δt0кипения =i Кэ См,
Δt0замерзания = i Кк См.
Закон Вант - Гоффа для растворов электролитов:
Росмотическое = i RTCB
Раствор неэлектролита |
|
Раствор электролита |
|
|
|
CB = 1 моль / л |
|
CB = 1 моль / л |
С12H22O11 |
|
NaСl= Na++Cl- |
Сахар в воде диссоциирует |
|
Соль в воде диссоциирует |
на молекулы |
|
на ионы |
1 моль молекул |
|
1 моль Na+ 1 моль Cl- |
|
|
Частиц будет больше |
|
|
в 2 раза |
|
|
Al(NO3)3=Al3++3NO-3 |
|
|
Al(NO3) = Al3+ + 3NO-3 |
|
|
(в 4 раза больше) |
|
|
1) 1< i <2 |
|
|
2) 1< i <4 |
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации.