
- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
Термохимия изучает энергетические эффекты химических реакций. Все энергетические эффекты в химии принято переводить в тепловые. Термохимия - раздел термодинамики.
Основным законом термодинамики и одним из важнейших законов природы является первое начало термодинамики. Этот закон был установлен в результате работ Майера (1842г) и Джоуля (1843г). Первым началом термодинамики этот закон назвал Р. Клаузиус .
Первое начало термодинамики
В замкнутой системе энергия не возникает и не исчезает, при переходе одних форм энергии в другие сумма их остаётся неизменной.
В термохимии принята своя терминология . Прежде всего - это понятие системы.
Под системой понимается отдельное вещество или смесь веществ, выделенные из окружающей среды физической или воображаемой границей.
Системы подразделяются на:
изолированные (замкнутые), у которых с окружающей средой нет обмена ни энергией, ни веществом;
закрытые, у которых с окружающей средой есть обмен энергией, но нет обмена веществом;
открытые, у которых с окружающей средой есть обмен энергией и веществом.
Макросостояние систем характеризуются параметрами (m, Т, Р, V, Е и другими). В термохимии очень важно понятие функций.
Функция параметра является функцией системы в том случае, если она зависит только от начального и конечного состояния системы, но не зависит от того пути, по которому система перешла от начального состояния к конечному.
Например, потенциальная энергия тела, находящегося у подножия горы, равна Е1.
Потенциальная энергия того же тела, поднятого на вершину горы, составляет Е2.
Разность потенциальных энергий составляет:
Е2 - Е1 = mg(h2 - h1).
Потенциальная энергия тела зависит только от разности высот, но не зависит от способа перемещения тела с данной высоты (h1) на другую (h2), поэтому потенциальная энергия представляет собой функцию состояния.
Состояние идеального газа определяется произведением давления на объём
P · V.
В начальном состоянии данная масса идеального газа характеризуется величинами P1 и V1 параметров состояния P и V.
После ряда превращений этот газ достигает конечного состояния равновесия, при котором давление и объём равны, соответственно, P2 и V2.
Произведение давления на объём зависит только от начального и конечного состояния газа и не зависит от пути, по которому это изменение произошло. Оно является функцией состояния.
Внутренняя энергия системы, то - есть полная энергия, - это сумма потенциальной энергии каждой частицы, составляющей систему, плюс кинетическая энергия взаимных положений частиц в системе.
Полная энергия тоже является функцией состояния идеального газа.
Внутренняя энергия простых систем, например химически чистого вещества или идеального газа, может быть выражено произведением двух параметров системы:
P·T, P·V.
Энтропия
Первое начало термодинамики ничего не говорит о направлении протекания процесса. О направлении протекания процессов говорит второе начало термодинамики.
Второе начало термодинамики:
Теплота не может переходить от менее нагретого тела к более нагретому телу.
Рассмотрим два резервуара в изолированной системе.

По мере перекачки энергии горячий резервуар охлаждается, а холодный нагревается. Следовательно, разность температур резервуаров уменьшается в течение всего периода времени, когда совершается работа.
Это означает, что количество энергии, которое может быть потрачено на работу (оно зависит от разности температур), должно всё время уменьшаться.
Энергия, которая уже перешла от теплопередатчика к приёмнику и превратилась в работу, называется связанной, или недоступной энергией, так как превратиться в работу она не может.
Для
обозначения этой связанной, или
недоступной, энергии Клаузиус ввёл
следующую термодинамическую функцию,
которую назвал энтропией
![]() S
(превращение).
S
(превращение).
Энтропия - отношение теплоты к температуре, при которой происходит переход энергии
S = Q/T Дж/моль к.
Физический смысл энтропии настолько сложен, что долгое время не был объяснён. Объяснил его Больцман. Он назвал энтропию термодинамической вероятностью существования системы, то - есть данному макросостоянию системы отвечает множество микросостояний.
Под микросостоянием системы понимается скорость и траектория каждой микрочастицы, составляющей систему, а также взаимное положение микрочастиц, число их столкновений и т.д.
Энтропия по Больцману : S = K · lnW,
где
W - вероятность состояния данной системы,
K - постоянная Больцмана.
Энтропия - мера неупорядоченности системы.
Определяется и рассчитывается абсолютная энтропия, приведённая к нормальным условиям.
Положительной энтропией обладают все реальные системы.
C (алмаз) - S0(c) = +2,38 Дж/моль к.
Отсюда вытекает третье начало термодинамики:
Нулевой энтропией обладают идеальные кристаллы при абсолютном нуле.
В реальных условиях в изолированной системе величина связанной, или недоступной, энергии возрастает, то - есть самопроизвольно энтропия может только возрастать
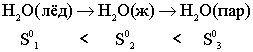 .
.
Данный процесс происходит с увеличением энтропии: ΔS0 > 0, обратный процесс ΔS0< 0.
Для самопроизвольных процессов в изолированной системе
ΔS0298 > 0 - необратимый процесс,
ΔS0298 = 0 - обратимый процесс.
Поскольку энтропия - функция системы, т.е. зависит от начального и конечного состояний системы, то изменение энтропии химического процесса зависит от вида и состояния исходных веществ и продуктов реакции.
aA + bB = cC +dD;
ΔS0х.р. = (cS0C + dS0D) - (aS0A + bS0B) Дж/к.
Для изолированных систем изменение энтропии позволяет предсказать, будет ли процесс необратимым или обратимым.
Если изменение энтальпии равно нулю, то процесс обратимый.
Эти критерии не могут быть использованы для закрытых систем.
Для закрытых систем вводится новая термодинамическая функция - энергия Гиббса (изобарно - изотермический потенциал).
Рассмотрим закрытую систему, в которой процесс протекает при постоянной температуре.
Согласно второму началу термодинамики разрешены следующие превращения:
для обратимого процесса: ΔS= Q/T; Qp =ΔS0T; Qp - ΔS0T= 0 ; ΔH0 - ΔS0T= 0;
для необратимого процесса: ΔS> Q/T; ΔS0T> Q; Qp < ΔS0T; Qp- ΔS0T<0; ΔH0-ΔS0T<0.
Разница между энтальпией и энтропией, помноженной на температуру, и есть энергия Гиббса
ΔH0 -ΔS0T = ΔG0.
Измеряется и рассчитывается только изменение энергии Гиббса:
ΔG0298 кДж/моль.
Для простых веществ изменения энергии Гиббса равны нулю. Изменение энергии Гиббса, также как и энтропии, говорит о направлении протекания процесса.
Самопроизвольный необратимый процесс возможен только в том случае, если изменение энергии Гиббса меньше нуля
ΔG < 0.
Знак изменения функции |
Возможность протекания реакции |
Пример реакции |
||
ΔH0 |
ΔS0 |
ΔG |
||
+ |
- |
+ |
Невозможно ни при каких условиях |
N2+2O2=2NO2 |
- |
+ |
- |
Возможно при любых условиях |
C2H2+7.5O2=6CO2+3H2O |
- |
- |
+ - |
Возможно при низких температурах |
3H2+N2=2NH3 |
+ |
+ |
+ - |
Возможно при высоких температурах |
N2O4=2NO2 |
Поскольку ΔG - функция системы, то эта функция также зависит от начального и конечного состояний химической реакции, то - есть от исходных веществ и продуктов реакции.
