
- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
 .
.
На катоде всегда происходит восстановление, на аноде - окисление
 .
.
2. Электролиз водного раствора электролита с пассивными электродами
 .
.
К катоду подходят ионы натрия и молекулы воды.
Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ
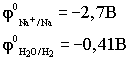 .
.
По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
Катодное восстановление воды:
![]() .
.
Чтобы выбрать, какое из веществ будет преимущественно окисляться на аноде, надо также сравнить их потенциалы
 .
.
По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
Анодное окисление хлора:
![]() .
.
Рассотрим ещё один пример электролиза раствора электролита с пассивными электродами:
 .
.
При таком соотношении потенциалов в первую очередь будет восстанавливаться вода:
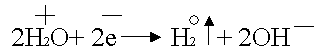 .
.
По соотношению потенциалов на аноде в первую очередь будет окисляться вода.
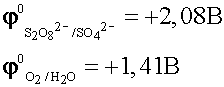 .
.
Анодное окисление воды:
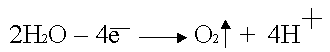 .
.
3. Электролиз раствора с активным анодом
Cu - активный анод, в качестве электролита - водный раствор H2SO4
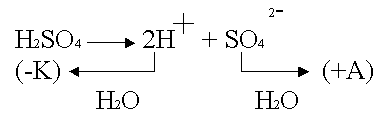 .
.
По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
 .
.
![]() .
.
На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод.
 .
.
По соотношению потенциалов активный анод будет окисляться в первую очередь:
![]() .
.
В силу диффузии ионы меди из анодого пространства, где их концентрация высока, будут перемещаться к катоду.
Когда
![]() достигнет
катода, то по соотношению потенциалов
меди и водорода, начнется восстановление
ионов меди:
достигнет
катода, то по соотношению потенциалов
меди и водорода, начнется восстановление
ионов меди:
![]() .
.
Законы Фарадея
Законы Фарадея являются количественными законами электролиза.
Первый закон Фарадея:
Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через раствор электричества
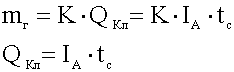 .
.
Второй закон Фарадея:
При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется 1 моль эквивалента вещества.
 -
электрохимический эквивалент вещества.
-
электрохимический эквивалент вещества.
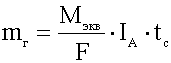 -
объединённый закон Фарадея.
-
объединённый закон Фарадея.
Поляризация при электролизе
Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения.
Химическая поляризация
Химическая поляризация возникает при использовании инертных электродов.
 .
.
![]() .
.
Какими бы ни были инертные электроды (Pt, С, керамика), все они прекрасно адсорбируют газы.
![]() .
.
Платина - анод насыщается хлором; платина - катод поглощает водород.
Хлор может только восстанавливаться, водород - окисляться:
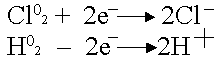 .
.
В электролизере образуется гальванический элемент:
![]() .
.
Электродвижущая сила возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его.
Данный вид поляризации называется химическим по той причине, что электроды как бы меняют свою химическую природу.
Поляризация играет отрицательную роль, так как она приводит к перерасходу электроэнергии.
С химической поляризацией борются химическим путем. В раствор добавляют вещества, которые очищают электроды от поглощённых газов.
