
- •Первое начало термодинамики
- •Энтропия
- •Второе начало термодинамики:
- •Скорость химических реакций
- •Пример решения задачи
- •Обратимые реакции
- •Пример решения задачи
- •Решение
- •Основные законы растворов
- •Понижение давления насыщенного пара над раствором (Первый закон Рауля)
- •Кипение и замерзание растворов ( Второй закон Рауля )
- •Закон Вант - Гоффа
- •Растворы электролитов
- •Степень диссоциации электролитов
- •Диполь- дипольный механизм
- •Диссоциация слабых электролитов
- •2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
- •Диссоциация сильных электролитов
- •Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Устройство и работа гальванического элемента
- •Водородный электрод сравнения
- •Концентрационные гальванические элементы
- •Окислительно - восстановительные (ов) гальванические элементы
- •Топливные элементы(тэ)
- •1. Электролиз расплава Электроды в данном случае выполнены из пассивных материалов (платина, графит)
- •2. Электролиз водного раствора электролита с пассивными электродами
- •3. Электролиз раствора с активным анодом
- •Концентрационная поляризация
- •Перенапряжение электрода
- •Коррозия металлов
- •Химическая коррозия:
- •Электрохимическая коррозия:
- •Гальванокоррозия
- •Защитные металлические покрытия
- •Защитные неметаллические покрытия
- •Оксидирование стали
Скорость химических реакций
Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
![]() .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
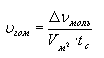 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
![]() .
.
Скорость реакции зависит от следующих факторов:
природа реагирующих веществ;
концентрация реагирующих веществ;
газовое давление;
температура.
Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс.
Запишем химическую реакцию в общем виде:
![]() .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
![]() ,
,
где
[А] и [В] - молярные концентрации веществ А и В; а и в - показатели степеней, соответствующие количеству моль веществ А и В; к - константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ.
Рассмотрим закон действия масс для конкретных реакций:
 .
.
Цинк - твердое вещество, его участие в реакции учитывается константой скорости химической реакции.
Влияние температуры на скорость химической реакции подчиняется уравнению Вант-Гоффа:
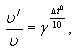
где
ν - начальная скорость реакции; ν'- измененная скорость; γ- температурный коэффициент; Δt0- изменение температуры реакции.
При
изменении температуры на 10oС,
скорость реакции
![]() изменяется
в 2÷4 раза, т. е. температурный коэффициент
находится в пределах от 2 до 4.
изменяется
в 2÷4 раза, т. е. температурный коэффициент
находится в пределах от 2 до 4.
Зависимость константы скорости реакции от температуры также подчиняется уравнению Вант-Гоффа:
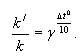
Пример решения задачи
При 20oС скорость реакции составляет 0,5. Чему равна скорость той же реакции при 70oС, если температурный коэффициент равен 2?
Решение
 .
.
Обратимые реакции
Обратимыми называются реакции, в которых ни одно из исходных веществ до конца не расходуется. Обратимые реакции с определенного момента протекают в обоих направлениях - прямом и обратном:
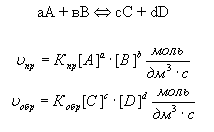 .
.
В обратимых реакциях устанавливается состояние равновесия, которое выражается в равенстве скоростей прямой и обратной реакций:
![]()
Состояние равновесия характеризуется константой равновесия (Кр):
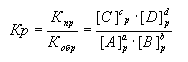 .
.
Индекс "р" означает равновесные концентрации веществ.
Состояние равновесия устойчиво и может сохраняться как угодно долго, пока на систему не будет оказано какое-либо внешнее воздействие:
изменение концентрации реагирующих веществ;
изменение газового давления;
зменение температуры.
Нарушение
состояния равновесия обратимой реакции
означает, что скорости прямой и обратной
реакций не равны друг другу. В зависимости
от этого, равновесие обратимой реакции
смещается либо в прямом
![]() ,
либо в обратном
,
либо в обратном
![]() направлении.
направлении.
Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
Рассмотрим примеры смещения равновесия. Дана система:
![]() .
.
Если увеличить концентрацию одного из исходных веществ (или одновременно обоих), то скорость прямой реакции превысит скорость обратной, и равновесие сместится в прямом направлении. Другими словами, система должна понижать повышенную концентрацию исходных веществ и смещаться в сторону образования продуктов реакции.
На примере этой же реакции рассмотрим смещение равновесия при изменении давления.
При увеличения давления равновесие смещается в сторону уменьшения числа молей.
При уменьшении давления равновесие сдвигается в сторону возрастания числа молей газообразных веществ, т. е. в сторону увеличения давления.
Следовательно, относительно рассматриваемой реакции при увеличении давления равновесие смещается в прямом направлении, в сторону образования аммиака, при понижении давления - в обратном направлении, в сторону исходных веществ.
Фактором, который определяет направление смещения равновесия при изменении температуры, является тепловой эффект реакции. Реакция является эндотермической, если протекает с поглощением тепла. Реакция, протекающая с выделением тепла, называется экзотермической.
Реакция синтеза аммиака:
![]()
является экзотермической; реакция разложения аммиака на водород и азот - эндотермическая.
При повышении температуры усиливается эндотермическая реакция, при понижении температуры - экзотермическая реакция.
В рассматриваемой реакции при повышении температуры равновесие смещается в обратном направлении, а при понижении температуры - в прямом, в сторону образования аммиака.
