
- •Проектирование и расчет узлов электронно-медицинской техники
- •Введение
- •1. Автоанализаторы газового состава крови
- •1.1. Принцип метода определения газов крови
- •1.2. Описание работы автогазоанализатора крови
- •1.3. Эксплуатация автогазоанализаторов крови
- •2. Гематологические автоанализаторы
- •2.1. Принцип метода определения счета клеток крови
- •2.2. Дифференцировка лейкоцитов
- •2.3. Принцип работы гематологических анализаторов
- •2.4. Значения параметров гематологических анализаторов
- •3. Усилитель как управляемый делитель напряжения
- •4. Основные сведения о работе с программой схемотехнического моделирования micro-cap
- •5. Статические характеристики биполярного транзистора
- •6. Однокаскадный усилитель на биполярном транзисторе
- •7. Анализ электронных схем с помощью идеальных усилительных элементов – нуллоров
- •Заключение
- •Список сокращений
- •Список литературы
- •Оглавление
- •Проектирование и расчет узлов электронно-медицинской техники
- •197376, С.-Петербург, ул. Проф. Попова, 5
2.2. Дифференцировка лейкоцитов
Субпопуляции лейкоцитов отличаются друг от друга по размеру. Разделение по размеру требует соблюдения условий (в том числе дилюент, лизирующий агент и время) при которых происходит лизирование. Когда процедура выполнена чисто, результаты этой химической реакции позволяют выделить 3 различимые группы: лимфоциты, клетки среднего размера и гранулоциты.
Лимфоциты – это самые малые из белых клеток. Они занимают область от 35 до 95 фл на гистограмме лейкоцитов.
Среднего размера клетки (эозинофилы, базофилы, моноциты) по размеру находятся между лимфоцитами и гранулоцитами. Эти клетки, модифицированные во время лизирования, занимают область от 95 до 130 фл на гистограмме лейкоцитов. Следует отметить, что некоторые редко встречающиеся мононуклеары, такие, как бласты и миелоциты, также находятся в этой области.
Нейтрофильные гранулоциты, модифицированные во время лизирования, так что цитоплазматические гранулы обжимаются вокруг ядра, являются самыми большими клетками из лейкоцитов. Они находятся в области выше 130 фл на гистограмме лейкоцитов.
Дифференциальный подсчет лейкоцитов заключается в регистрации всех встречающихся в поле зрения лейкоцитов раздельно по их принадлежности к тем или иным группам. При мануальном дифференциальном подсчете имеются 3 главных источника ошибок: неравномерное распределение клеток в препарате, неправильное распознавание клеток и статистическая погрешность. В первом случае имеет значение соблюдение правил передвижения препарата при дифференциальном счете клеток. Плохо приготовленный или плохо прокрашенный мазок – основная причина ошибок, связанных с неправильным распознаванием клеток. Наибольшая погрешность, однако, связана с тем, что подсчитывается малое количество клеток в образце – 100 или, в лучшем случае, 200. Для примера отметим, что содержание моноцитов равное 10 %, подсчитанное при анализе 100 клеток в световом микроскопе, на самом деле означает, что содержание моноцитов в крови колеблется
от 4,9 % до 17,6 % (при 95 % доверительном интервале). Тот же показатель, полученный при проточном анализе 10000 клеток, соответствует содержанию моноцитов от 9,4 % до 10,7 %. Увеличить же количество регистрируемых клеток при мануальном подсчете не представляется возможным, так как это сразу снижает производительность лаборатории [3].
2.3. Принцип работы гематологических анализаторов
Схема работы гематологического анализатора может быть представлена следующей последовательностью действий:
1) забор крови;
2) первое разведение;
3) перемешивание первого разведения;
4) подготовка второго разведения;
5) промывка заборной иглы;
6) второе разведение;
7) процесс подсчета;
8) промывка счетных камер и возвращение в исходное положение.
Качество результатов исследования крови на гематологическом анализаторе определяется следующими факторами:
- точностью дозирования цельной или разведенной крови;
- точностью дозирования изотонического раствора при проведении процедуры разведения крови;
- точностью определения объема суспензии, пропущенного через датчики подсчета клеток;
- точностью самого подсчета клеток;
- точностью определения размеров клеток;
- корректностью математических методов обработки первичных результатов измерений.
Проблема обеспечения точности и достоверности результатов измерений в гематологических анализаторах решается с помощью нескольких хорошо зарекомендовавших себя устройств: поворотного клапана, камеры предварительного разведения и датчика измеряемого объма.
При заборе пробы кровь поступает по магистрали заборника в канал поворотного клапана. После этого поворотный клапан поворачивается в другое положение, за счет чего из всей пробы выделяется точно заданный объем крови.
Далее через канал пропускается определенное количество разбавителя, в результате чего кровь вместе с изотоническим раствором поступает в камеру предварительного разведения, где происходит перемешивание первого разведения.
На рис. 2.3 и 2.4 представлены структурные схемы двух каналов анализатора: первый – для подсчета клеток эритроцитов и тромбоцитов, второй – для лейкоцитов. Схемы различаются тем, что канал подсчета лейкоцитов имеет гемоглобинометр для измерения гемоглобина фотометрическим методом. Оба канала содержат датчик счета клеток, работа которого описана в 2.1, и оптический детектор, позволяющий за счет регистрации светорассеяния (многоугловое поляризационное разделение пучка) измерять объем клетки, выполнять анализ клеточного цикла, анализ жизнеспособных клеток.
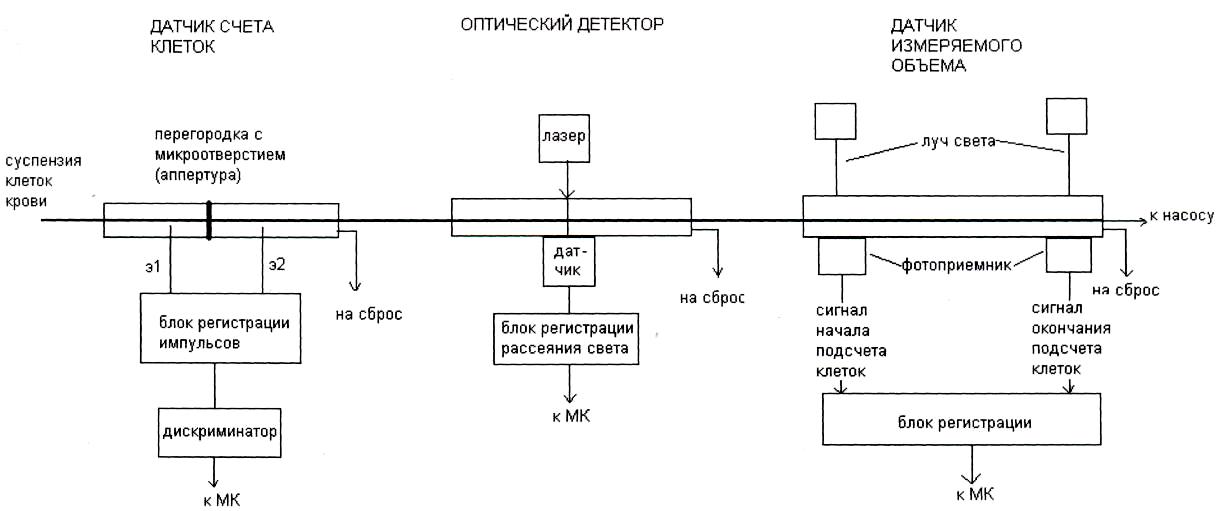
Рис. 2.3. Система датчиков для определения эритроцитов и тромбоцитов (из фирменного описания прибора)
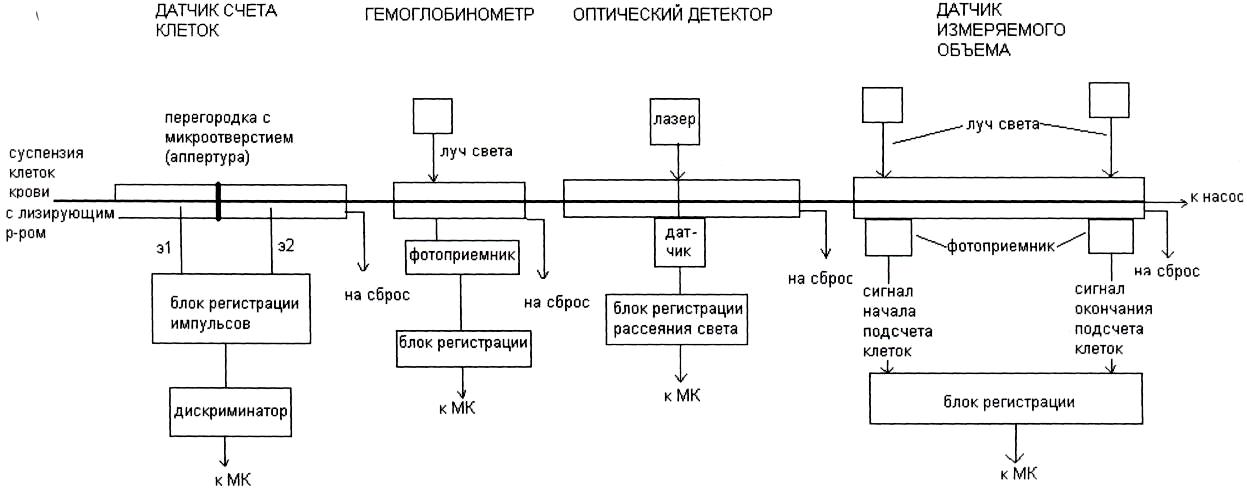
Рис. 2.4. Система датчиков для определения лимфоцитов
(из фирменного описания прибора)
При определении концентрации клеток крови через микроотверстие датчика необходимо пропустить точно известный объем разведенной крови. Для измерения объема суспензии, в котором подсчитывается число клеток, используется датчик измеряемого объема. Это стеклянная трубка, к которой прикреплены на некотором расстоянии друг от друга оптоэлектронные датчики. Эти датчики регистрируют прохождение между ними мениска жидкости.
Датчик измеряемого объема встраивается в гидравлическую схему анализатора между датчиком счета клеток и насосом, обеспечивающим разряжение для всасывания суспензии через микроотверстие. При подсчете клеток крови суспензия начинает заполнять магистраль и в какой-то момент времени проходит через первый оптоэлектронный датчик. Это служит сигналом для начала подсчета электрических импульсов, которые появляются в момент прохождения клеток крови через микроотверстие. Когда мениск суспензии достигнет второго датчика, подсчет импульсов прекращается. Таким образом, анализатор подсчитал число клеток крови в точно заданном объеме, который определяется диаметром трубки и расстоянием между оптоэлектронными датчиками.
Время от времени при измерении очередной пробы крови прибор выдает сигнал о том, что микроотверстие датчика засорилось и его следует прочистить. Причины засорения микроотверстий датчика связаны с тем, что в суспензии разведенной пробы крови присутствует множество структур, способных прилипать к поверхности канала микроотверстия – белки, липиды, тромбоциты и др. При этом поверхность с абсорбированными на ней молекулами обладает еще большими сорбционной и адгезивной способностями. В конце концов, просвет микроотверстия существенно сужается, что приводит к изменению характеристик датчика и замедляет скорость прохождения суспензии через него.
В гематологическом анализаторе эта проблема решена следующим образом. После каждого цикла измерения через микроотверстие датчика пропускается чистый раствор, содержащий детергенты. Это позволяет смывать с поверхности микроотверстия сорбированные частицы. Для ликвидации засора применяется электродинамическая очистка. Сущность этой процедуры состоит в том, что через микроотверстие пропускается импульс электрического тока такой силы, что формируется фронт ударной волны, который эффективно очищает поверхность от налипших частиц. Автоматический контроль состояния микроотверстия позволяет своевременно произвести электродинамическую очистку перед очередным измерением пробы крови.
Обобщенная структурная схема гематологического анализатора (рис.2.5) содержит 2 ранее описанных канала, перистальтический насос, микропроцессорный блок и подачу реагентов. Микропроцессорный блок управляет работой анализатора, осуществляет измерение и дальнейшую обработку полученных данных, рассчитывает заданные параметры, посылает необходимую информацию на индикатор и печать, сохраняет полученные результаты в журнале пациентов.
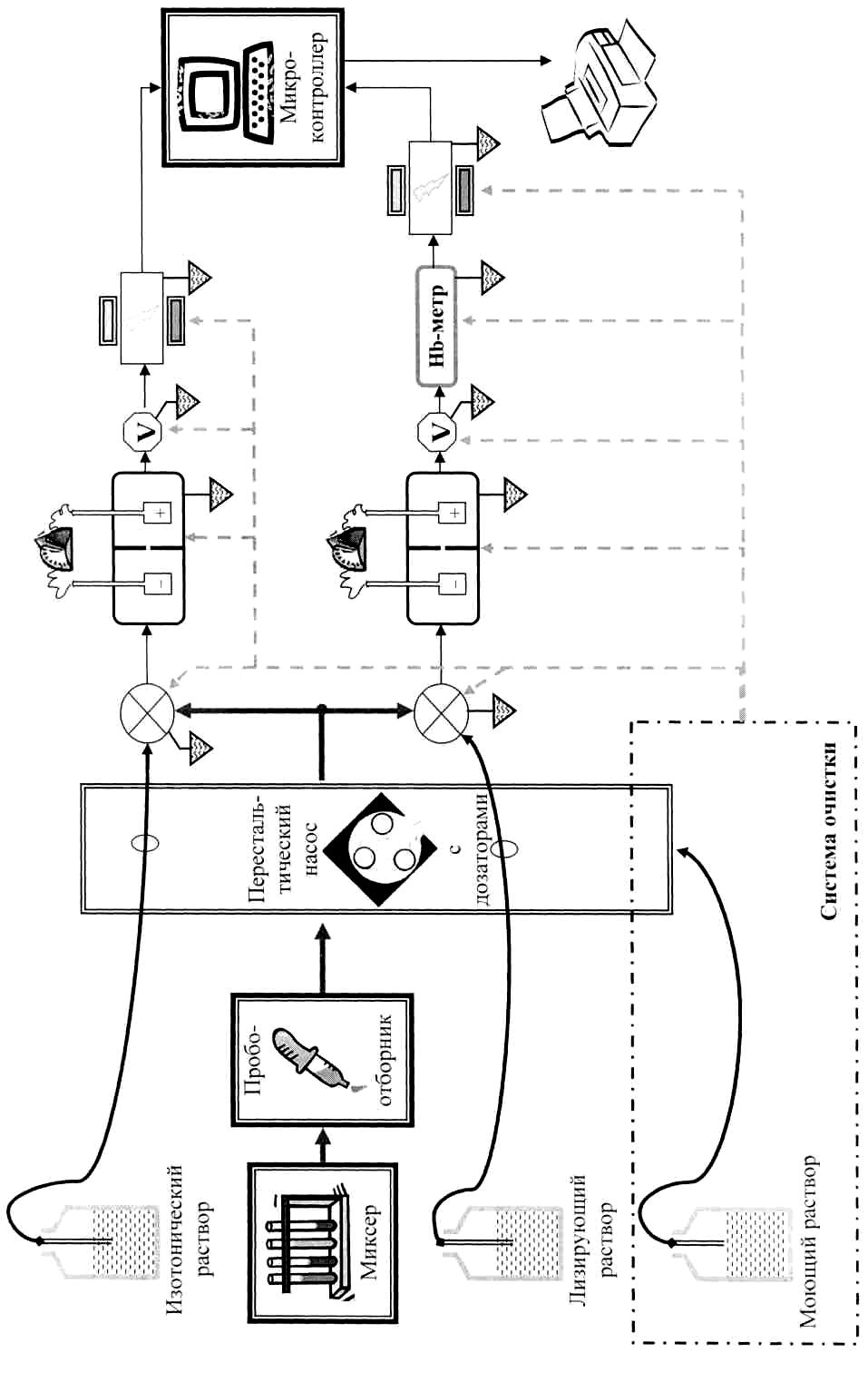
Рис. 2.5. Схема гематологического анализатора (из фирменного описания прибора)
