- •Проектирование и расчет узлов электронно-медицинской техники
- •Введение
- •1. Автоанализаторы газового состава крови
- •1.1. Принцип метода определения газов крови
- •1.2. Описание работы автогазоанализатора крови
- •1.3. Эксплуатация автогазоанализаторов крови
- •2. Гематологические автоанализаторы
- •2.1. Принцип метода определения счета клеток крови
- •2.2. Дифференцировка лейкоцитов
- •2.3. Принцип работы гематологических анализаторов
- •2.4. Значения параметров гематологических анализаторов
- •3. Усилитель как управляемый делитель напряжения
- •4. Основные сведения о работе с программой схемотехнического моделирования micro-cap
- •5. Статические характеристики биполярного транзистора
- •6. Однокаскадный усилитель на биполярном транзисторе
- •7. Анализ электронных схем с помощью идеальных усилительных элементов – нуллоров
- •Заключение
- •Список сокращений
- •Список литературы
- •Оглавление
- •Проектирование и расчет узлов электронно-медицинской техники
- •197376, С.-Петербург, ул. Проф. Попова, 5
1. Автоанализаторы газового состава крови
1.1. Принцип метода определения газов крови
Для определения газового состава крови в современных газоанализаторах используются в основном электрохимические методы анализа. Электрохимические методы анализа, совокупность методов качественного и количественного анализа, определяющих структуру, химический состав, концентрацию анализируемого вещества. Эти методы основаны на исследовании процессов, происходящих в электрохимической ячейке, содержащей не менее двух электродов, погруженных в электролит.
Электрохимические методы анализа делятся на 5 основных групп: потенциометрию, вольтамперометрию (полярографию), кулонометрию, кондуктометрию и диэлектрометрию. В газоанализаторах применяют методы, основанные на измерении потенциала электрода (потенциометрию), количества электричества (кулонометрию), тока (полярографию).
Анализатор газов крови – прибор клинико-диагностической лаборатории (КДЛ) любого лечебно-профилактического учреждения (ЛПУ), имеющего в своем составе реанимацию и/или палату интенсивной терапии.
Газоанализаторы измеряют не только основные параметры, такие как pH, pO2 и pCO2, но могут также обеспечивать измерение электролитов ( К, Na, Ca, Cl) и метаболитов (Lac, Glu, Bil) (табл.1.1). Современные анализаторы содержат «ко-оксиметр», который позволяет измерять базовые параметры: общую концентрацию гемоглобина в крови (ctHB) и насыщение гемоглобина кислородом (sO2), а также фракции оксигемоглобина (FHbO2), карбокси гемоглобина (FHbCO), метгемоглобина (FHbMet), фетального гемоглобина (FHbF), суммы окси- и деоксигемоглобина (FHHb).
Измерение трех параметров «золотого стандарта» рН, рО2, рСО2 в артериальной крови необходимо при проведении оперативных вмешательств под общей анестезией с искусственной вентиляцией легких (ИВЛ); проведении продленной ИВЛ в послеоперационном периоде; пациентам отделений реанимации и интенсивной терапии в ЛПУ*. В частности, рСО2 необходимо для констатации диагноза «смерть мозга».
Измерение основных электролитов (К+, Na+, Са2+, Cl-) проводятся при замещении функции почек, применении методов экстракорпоральной детоксикации – гемосорбции, ультрагемофильтрации, проведении гемодиализа и др. В данном случае измерить необходимые параметры можно газоанализатором, сочетающим в себе анализатор кислотно-основного состояния (КОС), газов крови и электролитов.
Параметры кислородного статуса, измеряемые фотометрическим способом при помощи так называемого ко-оксиметра, (ctHb, SO2%, FHbO2, FHHb, FHbCO, FHbМet, FHbF), требуется определять у пациентов с системной гипоксией разного генеза.
Таблица 1.1.
Измеряемые параметры |
Диапазон |
pH |
6.6…7.8 |
pСО2 – парциальное давление углекислого газа |
10…200 мм рт. ст. |
pО2 – парциальное давление кислорода |
10…700 мм рт. ст. |
Na+ |
100…180 ммоль/л |
K+ |
0.8…9.99 ммоль/л |
Ca++ |
0.2…3.0 ммоль/л |
Гемоглобин |
5… 25 г/дл |
Глюкоза |
30…400 мг/дл (1.7…22 ммоль/л) |
Мочевина |
3…112 мг/дл (1…40 мг/л) |
Насыщение кислородом |
60 … 99.9 % |
Барометрическое давление |
300… 800 мм рт. ст. |
Актуальный бикарбонат НСО2 |
1…200 ммоль/л |
Избыток оснований (ВЕ) |
– 40 +40 ммоль/л |
Избыток оснований в межклеточной жидкости |
– 40 +40 ммоль/л |
Актуальный избыток оснований |
– 40 +40 ммоль/л |
Буферная база (ВВ) |
0 … 100 ммоль/л |
Общее содержание СО2 |
1…200 ммоль/л |
Стандартный бикарбонат (st. HCO2) |
1…200 ммоль/л |
Стандартный рН |
6.5…8.0 |
Стандартный рН |
6.5…8.0 |
Окончание табл.1.1.
Измеряемые параметры |
Диапазон |
Насыщение кислородом |
0…100 % |
Содержание кислорода |
0…56 мл/дл |
Гематокрит |
15…75 % |
Концентрация ионов водорода |
1000…10 нмоль/л |
Альвеолярно-артериальная разница оксигенации |
0…800 мм рт. ст. |
Стандартизированный ионизированный кальций (pH 7,4) |
0,1…3,0 ммоль/л |
Напряжение кислорода при 50 %-й десатурации |
15…35 мм рт. ст. |
Эра современной лабораторной экспресс-диагностики неотложных состояний связана с пандемией полиомиелита в 50-х г.г. ХХ в., массовым поступлением больных с необходимостью проведения длительной ИВЛ. Это в свою очередь явилось стимулом для разработки анализаторов для измерения основных параметров КОС и газов крови. Содружество врачей (группа доктора Пола Аструпа) и инженеров компании «Радиометр» (Дания) обеспечило создание первых анализаторов газов крови и КОС уже в 50-х г.г. Первые несовершенные анализаторы с большим перечнем ручных процедур, тем не менее, должны были отвечать требованиям экспресс-диагностики неотложных состояний или так называемого STAT-анализа:
- короткий цикл измерения – 1…2 минуты;
- быстрое получение результата от момента принятия решения о выполнении анализа до получения распечатки данных – 5…10 минут;
- минимальный объем пробы крови до 200 мкл, учитывая необходимость достаточно частого повторения забора пробы.
Эти требования в дальнейшем сохранились и для последующих поколений анализаторов, выполняющих уже более широкий спектр измерений параметров STAT-анализа. Развитие анестезиологии и реаниматологии, попытки замещения наряду с функцией дыхательной системы функции почек стимулировало разработку электродов для определения концентрации важнейших электролитов крови. В состав анализаторов газового состава крови были включены ион-селективные электроды с возможностью измерения в той же микропробе цельной крови таких параметров, как концентрация К+, Na+, Ca2+, Cl-. Были созданы также литиевый и магниевый электроды. Но так как литий остается наиболее востребованным лишь в неотложной психиатрии, а магниевый электрод, при интересе к этому параметру ряда специалистов, достаточно нестабилен, то наиболее широкое применение в медицинской практике дополнительно к основным параметрам STAT-анализа получили 4 вышеназванных электролита.
В современных газоанализаторах используется новое поколение электродов и система жидкостной калибровки для определения содержания газов и электролитов крови.
Преимуществом этих новых электродов является то, что в них используются общепринятые принципы и технологии, но таким образом, что для измерения требуется крайне маленький объем пробы. Объем пробы, необходимый для заполнения одного электрода, составляет 3…4 мкл.
Все электроды проточные, с хорошо просматриваемым путем прохождения пробы. Активная поверхность электродов, будучи защищенной внутри проточного канала, обеспечивает высокую воспроизводимость результатов.
Рассмотрим 3 основных электрода для определения параметров «золотого стандарта» рН, рО2, рСО2.
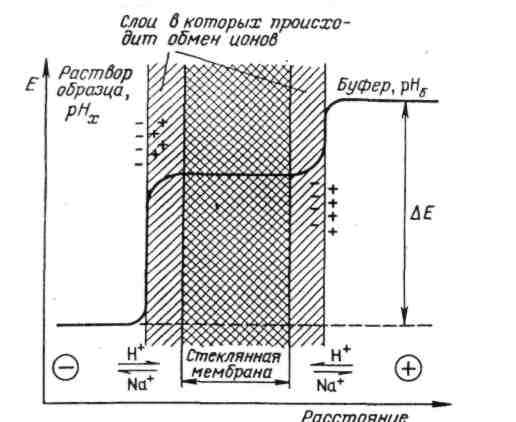
Электрод рН является проточным стеклянным рН-электрод с использованием чувствительной рН стеклянной мембраны. В зависимости от рН пробы на пограничной фазе между стеклянным капилляром и пробой генерируется электрический заряд. Этот заряд можно измерить (гальванометрическим методом). Для замыкания электрической цепи необходимо наличие второго электрода, референтного.
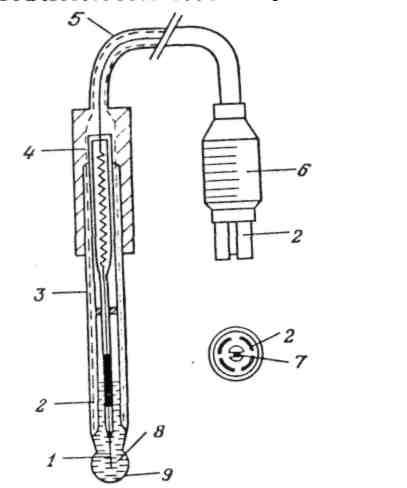
Величина рН считается характеристикой активности (а) ионов водорода: рН = – lg а н+ . Для измерения рН в качестве индикаторного электрода используется стеклянный электрод (рис. 1.1.). Корпус 3 выполнен из обычного стекла, на конце - тонкостенный стеклянный шарик 9, заполненный буферным раствором НСl (рН = 7). Внутри стеклянного электрода находятся: 1 – стандартный хлорсеребряный электрод сравнения Эсравн : 2 – экран; 4 – изолирующая головка; 5 – провод; 6 – разъем; – 7 центральный провод электрода.
Основной принцип заключается в возникновении разности потенциалов Δ Е между стеклянной мембраной (М) 9 и раствором пробы: Δ Е ~ рН раствора, что определяется особым строением ионообменной М (толщина 0,01мм). Стекло реагирует с ионами Н+, которые входят в полости кристаллической решетки и устанавливается равновесие между ионами Н+ во внутреннем и внешнем растворах.
Э
Рис.
1.1. Электрод для
измерения рН
Мембрану стеклянного электрода изготовляют из специальных стекол, подбирая их так, чтобы мембрана проявляла особую селективность к ионам водорода. Обычно стекло для мембраны, содержит 22 % оксида натрия, 6 % оксида кальция, 72 % оксида кремния. Для измерения мембрану хорошо вымачивают в воде, поэтому на обеих ее сторонах образуется тонкий слой гидратированного геля и все пустоты в атомной сетке стекла занимают ионы Н+, вытесняя ионы натрия.
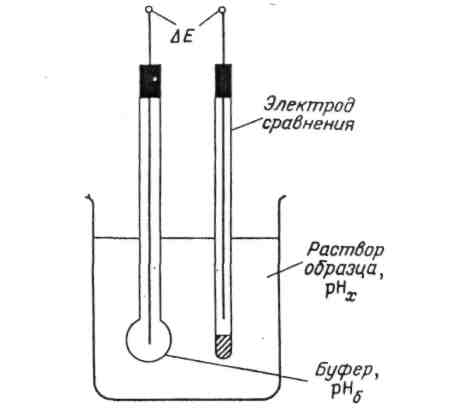
Для измерения рН образца используют двухэлектродную ячейку, заполненную буферным раствором (рис. 1.3), в который погружены 2 электрода: индикаторный - стеклянный рН-электрод; электрод сравнения (референтный) – чаще всего используется каломельный либо хлорсеребряный электрод.
Электрод рО2 представляет собой электрод Кларка. Определенное количество кислорода, в зависимости от его парциального давления в пробе, проходит через мембрану и замещает молекулы кислорода электролита. На катоде происходит восстановление кислорода, диффундирующего через мембрану, посредством реакций, вызывающих ток между катодом и анодом, пропорциональный напряжению кислорода.
|
|
Рис. 1.2. Соотношение потенциалов |
Рис. 1.3. Ячейка для измерения рН на мембране электрода |
Определение рО2 с помощью полярографического электрода Кларка наиболее распространено. Электрод состоит из платинового катода, серебряного анода и раствора электролита (например, хлорида калия), замыкающего цепь между ними. От исследуемой фазы электроды и раствор электролиза отделены полипропиленовой мембраной, проницаемой для кислорода. Через цепь, образованную этими элементами, пропускают постоянный ток, между катодом и анодом возникает разность потенциалов (явление поляризации). Электропроводность раствора, а следовательно, и сила тока зависят от количества кислорода, поступающего через мембрану. Электрод Кларка, как правило, калибруют по термостатной воде, напряжение кислорода в которой можно рассчитать, зная атмосферное давление. Это чревато серьезными ошибками; например, парциальное давление кислорода занижается тем больше, чем выше истинное рО2. Дело в том, что электроды этого типа обладают «памятью», т. е. результаты конкретного измерения зависят от РО2, жидкости, перед этим заполнявшей камеру. Для устранения этой ошибки при калибровке используют газовые смеси с различным содержанием кислорода. Другим источником ошибок служат нарушения правил взятия проб, повреждения полупроницаемой мембраны и пузырьки воздуха в растворе электролита или в пробе крови. Время определения 5-6 мин, объем пробы для микрометода 100 мкл.
В качестве примера простого амперометрического сенсора рассмотрим предложенную Л. Кларком в середине ХХ в. конструкцию гальванического электрода для определения концентрации кислорода в окружающей среде (рис. 1.4.).
В
Рис.
1.4. Конструкция "кислородного"
амперометрического сенсора Кларка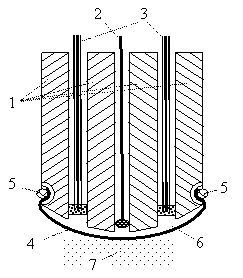 пластмассовом цилиндрическом корпусе
1 сделаны сквозные отверстия для
проводников, в которых размещены
индикаторный (рабочий) электрод 2 из
платины и электрод сравнения 3 из
серебряных проволок, концы которых
покрыты пастой из хлорида серебра.
Нижний конец корпуса обтягивают
газопроницаемой полимерной мембраной
4 из полипропилена (полиэтилена,
фторопласта, целлофана и т. п.), которую
механически фиксируют на корпусе с
помощью резинового кольца 5. В пространство
между электродами и мембраной залит
водный раствор хлорида кальция 6. Извне
мембрана 4 контактирует с контролируемой
средой 7. Это может быть как жидкость,
так и газ.
пластмассовом цилиндрическом корпусе
1 сделаны сквозные отверстия для
проводников, в которых размещены
индикаторный (рабочий) электрод 2 из
платины и электрод сравнения 3 из
серебряных проволок, концы которых
покрыты пастой из хлорида серебра.
Нижний конец корпуса обтягивают
газопроницаемой полимерной мембраной
4 из полипропилена (полиэтилена,
фторопласта, целлофана и т. п.), которую
механически фиксируют на корпусе с
помощью резинового кольца 5. В пространство
между электродами и мембраной залит
водный раствор хлорида кальция 6. Извне
мембрана 4 контактирует с контролируемой
средой 7. Это может быть как жидкость,
так и газ.
Если в контролируемой среде кислорода нет, то при подаче напряжения между электродом сравнения (анод) и рабочим электродом установившийся стационарный ток очень слаб. При наличии в контролируемой среде кислорода его молекулы диффундируют сквозь мембрану 4 и через раствор 6. Когда они достигают индикаторного электрода 2, то благодаря каталитическим свойствам платины здесь происходит реакция восстановления:
О2 + 4е– + 4Н+ = 2Н2О,
вследствие которой ток через электрохимический элемент значительно возрастает.
Стационарный ток линейно зависит от концентрации кислорода в контролируемой среде. Этим данный сенсор существенно отличается от потенциометрических газовых сенсоров, у которых разность электродных потенциалов зависит от концентрации газа логарифмически. Соответственно в амперометрических газовых сенсорах диапазон измеряемых концентраций более узок, чувствительность ниже, но точность определения концентрации в рабочем диапазоне выше. Рабочий диапазон измеряемых концентраций зависит как от конструктивных факторов, так и от значения приложенного напряжения.
Электрод рСО2 является электродом типа «Severinghouse». Диффузия диоксида углерода через мембрану идет в обоих направлениях. Диффундирующий СО2 изменяет значение рН электролитов. Это изменение, пропорциональное рСО2 пробы, измеряется стеклянным электродом рН.
Электрод для определения напряжения углекислого газа представляет собой рН-метр, в котором измеряющий и референтный электроды окружены раствором бикарбонатного буфера и отделены от крови тонкой мембраной, проницаемой для газов и непроницаемой для ионов НСO3. Углекислый газ диффундирует из крови через мембрану, вследствие чего меняется рН бикарбонатного буфера. Чем выше напряжение углекислого газа крови, тем большее количество молекул СO2 проникает через мембрану.
Диоксид углерода – конечный продукт обменно-окислительных процессов в клетках и тканях организма – переносится кровью к легким и удаляется через них во внешнюю среду (99,5 % CO2 покидает организм через легкие и только незначительная часть выделяется почками) [1].
Диоксид углерода может переноситься как в физически растворенном виде, так и в составе обратимых химических соединений. Химические реакции связывания CO2 сложнее и многообразнее, чем реакции присоединения кислорода. Это обусловлено тем, что механизмы, отвечающие за транспорт углекислого газа, должны обеспечивать и постоянство кислотно-основного состояния крови.
Диоксид углерода находится в крови в следующих формах:
– в растворенном виде в плазме – 5 %;
– в связи с аминогруппами гемоглобина – 15 %;
– в виде угольной кислоты (Н2СO3) – незначительное количество;
– в виде бикарбонат-ионов (НСО3), обеспечивающих постоянство активной реакции крови (рН), – более 80 %.
В нормальных условиях в артериальной крови напряжение CO2 (РаCO2) составляет около 40 мм рт. ст. (с колебаниями от 35 до 45 мм рт. ст.). Повышение РаCO2 называется артериальной гиперкапнией, снижение –артериальной гипокапнией.
Нарушения газового состава крови выявляются при большинстве заболеваний легких. По показателям газового состава артериальной крови можно судить о функции легких в целом.
Ион-селективные (мембранные) электроды (ИСЭ) – это электроды, равновесный потенциал которых в растворе электролита, содержащем определенные ионы, избирательно зависит от концентрации этих ионов. Такие электроды в газоанализаторе используются для определения концентрации (активности) К+, Na+, Ca2+, Cl- ионов в растворе.
Ион-селективный электрод представляет собой устройство, основным элементом которого является мембрана, проницаемая только для определенного иона. Между растворами электролитов, разделенных мембраной, устанавливается стабильная разность потенциалов, которая алгебраически складывается из двух межфазных скачков потенциала и диффузионного потенциала, возникающего внутри мембраны. Измерение концентрации определенного иона возможно по значению ЭДС гальванического элемента, составленного из находящихся в контакте исследуемого и стандартного растворов, в каждый из которых погружены идентичные ион-селективные электроды, избирательно чувствительные к определенному иону; концентрация этого иона в стандартном растворе точно известна. Для практических измерений гальванический элемент составляют из ион-селективного электрода и электрода сравнения (например, хлорсеребряного), который сначала погружают в стандартный, а затем в исследуемый раствор; разность соответствующих ЭДС равна ΔЕ. Состав стандартного раствора должен быть по возможности близок к составу измеряемого.
Устройство ИСЭ (рис.1.5.): в полом корпусе находится внутренний электрод сравнения 3 – обычно AgCl, погруженный во внутренний буферный раствор 4, содержащий ионы Х (a1) и ионы Cl–, корпус отделен от раствора пробы 7 (а2), полупроницаемой мембраной 6, обладающей селективностью к ионам Х. В исследуемый раствор 8 также погружен внешний электрод сравнения 2, закрытый жидким мостиком 1. Потенциалы мембран (5) и (7) описываются соответственно выражениями:
E1 = Е0 + (RT/nF) ln a1,
Е2 = Е0 + (RT/nF) ln a2.
Между поверхностями мембраны 5 и 7 устанавливается ΔЕ = Е' + (RT/F) ln (a1/а2), при а1 = const ΔЕ ~ ln a2, т. е. зависит только от концентрации ионов Х в растворе пробы.
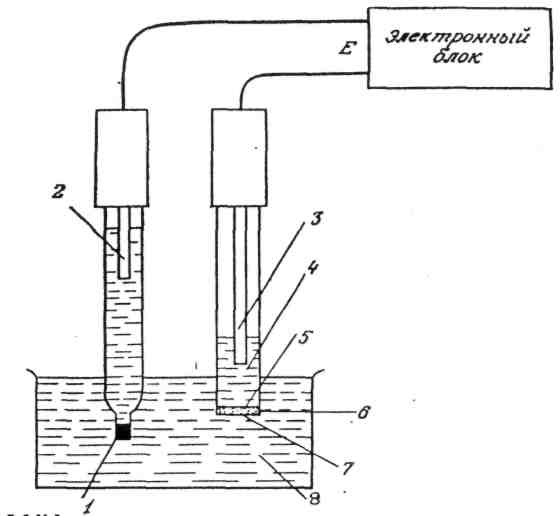
Рис. 1.5. Схема измерений с использованием ИСЭ
Электроды для определения ионного состава пробы вырабатывают на выходе разность потенциалов, пропорциональную содержанию измеряемого в пробе параметра. Референтный (сравнения) электрод должен всегда генерировать одинаковый сигнал независимо от состава пробы. Это достигается смешиванием потока пробы с потоком жидкости, содержащей КСl (референтный раствор) высокой концентрации. Часть КСl, вступающая в контакт с пробой, обновляется после каждой пробы. Противоположный конец электрода, чувствительный к хлору, контактирует с потоком КС1. Поскольку концентрация КС1 не изменяется, не меняется и сигнал данного хлорного электрода.
Этот дополнительный электрод не выполняет измерительную функцию. Его задача - создать воздушный пузырек между референтным электродом и другими электродами во избежание обратного потока референтного раствора к активным электродам, что уменьшает расход калибровочных растворов.
Натриевый электрод очень похож на рН-электрод, но в нем используется чувствительный к натрию стеклянный капилляр. Для нормального функционирования натриевого электрода необходим референтный электрод. Как уже отмечалось, все электролитные электроды подразумевают использование референтного электрода.
Калиевый электрод. Активная зона этого электрода расположена посредине измерительного канала. Мембрана представляет собой смесь пластицированного полихлорвинила с валиномицином и добавками. Сигнал генерируется тогда, когда калий движется от пробы в пограничный слой мембраны, вырабатывая таким образом регистрируемый электрический разряд.
Кальциевый электрод является потенциометрическим датчиком. По существу он работает аналогично калиевому электроду, но для увеличения чувствительности к кальцию, используется другой состав мембраны. Вместо валиномицина используется синтетический нейтральный носитель, обеспечивающий возможность перемещения ионизированного кальция в мембрану. Этот электрод измеряет только ионизированный кальций, присутствующий в пробе.
Гемоглобин определяется фотометрическим методом, путем измерения оптической плотности гемолизированной крови при постоянной длине волны. Закон поглощения Бугера–Лэмберта–Бера постулирует, что оптическая плотность пропорциональна длине прохождения света и концентрации поглощающего компонента в растворе. Поглощающим свет компонентом является гемоглобин (преобладающими фракциями гемоглобина являются оксигемоглобин и дезоксигемоглобин). Измерительная камера представляет собой пластиковую кювету. Эта кювета заменяема, и ее юстировка (длина оптического пути) производится с помощью внешнего калибратора.
Гематокрит определяется путем измерения проводимости. Проводимость крови зависит от концентрации ионов в плазме, которая влияет на электрическую проводимость, и от волюметрической фракции клеток крови (Hct), которая не влияет на электрическую проводимость.