
- •Методичні вказівки
- •«Охорона повітря від забруднення та його нормування в газовому середовищі»
- •Охрана воздуха
- •Окислительная деградация и детоксикація атмосферных загрязнителей растениями
- •Методичні вказівки
- •«Поширення хімічних елементів та їх сполук в біосфері. Кларки основних хімічних елементів земної кори»
- •Методичні вказівки
- •«Комплексометричне визначення кальцію і магнію в рослинах»
- •Методичні вказівки
- •«Визначення марганцю в рослинах (за методом а.А. Власюка і л.Д. Лейденської)»
- •Методичні вказівки
- •«Визначення міді в рослинах»
- •Методичні вказівки
- •«Визначення бору в рослинах ( за методом х. М. Починка)»
- •Концентрація в, мкг/мг
- •Методичні вказівки
- •«Прискорене визначення азоту, фосфору і калію з однієї наважки (за методом к. Гінзбург та ін. )»
- •Методичні вказівки
- •«Визначення небілкового і білкового азоту в одній наважці методом хлораміну ( за методом х.М. Починка)»
- •Методичні вказівки
- •«Міграція хімічних елементів в організмі людини, тваринних та рослинних організмах»
0
0.1
0,8
1,2
1,6
2
Рис.
1. Калібрувальний графік для бору
(світлофільтр з максимумом пропускання
610 нм. кювета з товщиною вимірюваного
шару 10 мм): 1 - у хіналізарином:
2-і
карміном.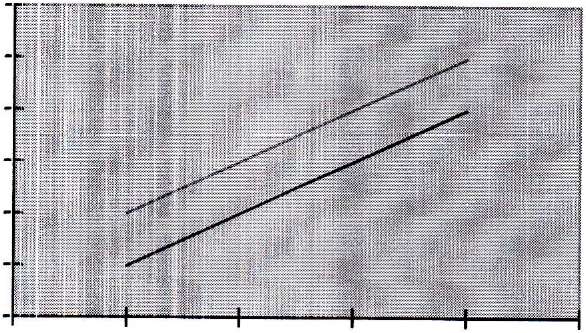
Концентрація в, мкг/мг
Міністерство освіти і науки України
Криворізький технічний університет
Кафедра прикладної екології
Методичні вказівки
До виконання лабораторної роботи з курсу «Біогеохімія»
Для студентів спеціальності 7.070801
«Екологія та охорона навколишнього середовища»
Лабораторна робота № 7
«Прискорене визначення азоту, фосфору і калію з однієї наважки (за методом к. Гінзбург та ін. )»
Мета лабораторної роботи: На основі рослинних зразків визначити присутність азоту, фосфору та калію прискореним методом ( за методом К. Гінзбурга та ін. )
Затверджено на засіданні
кафедри
прикладної екології
протокол
№_2__від _11.10___2010 р.
Кривий Ріг
2010
з
Обладнання, об'єкти, реактиви: торсійні терези; електроплитка, електроколориметр; полуме-невий фотометр; термостійкі колби; мірні колби місткістю 100—200 мл; піпетки місткістю 5,10 мл; скляні палички; досліджувані рослини; реактиви.
Реактиви: Селен, реактив Неслера, суміш H2S04 і НСЮ4 (на кожні 5 мл концентрованої H2S04 додають 0,8 мл 30%-го розчину НС104), 25%-й розчин сегнетової солі, 30%-й розчин NaOH, лакмусовий папір, 25%.-й розчин молібдату амонію (12,5 г х. ч. перекриста- лізованогс молібдату амонію розчиняють у 100 мл дистильованої води, підігрітої до 50— 60 °С.(якщо є каламуть, розчин фільтрують). Одночасно в колбу місткістю 500 мл наливають 200 мл води і дуже обережно, малими порціями, по стінці доливають 140 мл концентрованої H2S04. Охолоджений до кімнатної температури розчин H2S04 виливають у мірну колбу місткістю 500 мл. Сюди повільно доливають розчин молібдату амонію, весь час помішуючи, розбавляють до риски дистильованою водою, ще раз збовтують і зберігають у закритій темній склянці. Розчин сульфату гідразину 5 г розчиняють у 200 мл дистильованої води при 40—50 °С. Розчини зливають у мірну колбу місткістю 500 мл і дистильованою водою розбавляють до риски. Розчин сульфату амонію 1,1816 г х. ч. (NH4)2S04 розчиняють в 1л дистильованої води (вихідний розчин). Для виготовлення стандартного розчину 10 мл вихідного розчину розбавляють до 500 мл дистильованою водою. В 1 мл такого розчину міститься 0,005 мг азоту. Стандартний розчин КН2Р04 0,1917 г х. ч. перекристалізованого розчиняють у 100 мл дистильованої води, яку підкислюють кількома краплями концентрованої H2S04, переливають у мірну колбу місткістю 1 л, розбавляють дистильованою водою до риски . З цього розчину беруть 50 мл в мірну колбу на 1 л, розбавляють до риски водою, перемішують. Титр такого розчину дорівнює 0,005 мг Р205. Стандартний розчин KCl 0,7915 двічі перекристалізованого KCl розчиняють в 1л дистильованої води. Цей розчин містить 0,5 мг К20 в 1 мл. З нього готують шкалу стандартних розчинів (табл.). У колбу на 250 мл наливають 1, 2, 4, 5,10, 20, 40 і 50 мл вихідного розчину, розбавляють дистильованою водою до риски, добре перемішують і вимірюють на полуменевому фотометрі.
Виготовлення шкали стандартних розчинів KCl для побудови калібрувального графіка
Номер колби - стандартним |
Кількість вихідного розчину, |
Вміст К20 віл стандартного |
розчином |
мл |
розчину, кр. |
1 |
1 |
2 |
2 |
2 |
4 |
3 |
4 |
8 |
4 |
5 |
10 |
5 |
10 |
28 |
6 |
20 |
48 |
7 |
40 |
80 |
8 |
50 |
100 |
Основні відомості. Фосфор і калій, так само як і азот, необхідні елементи для життя рослин. Сполуки фосфору і калію, які містяться в рослинному організмі різноманітні за своєю хімічною будовою і фізіологічними функціями. Метаболізм вуглеводів та інших речовин неможливий без фосфорних і калійних сполук. З хімічною реакцією фосфатів пов'язана енергетика живої клітини. В рослину фосфор і калій надходять з грунту.
Визначаючи загальний вміст азоту, фосфору і калію в одній наважці, можна говорити про винесення цих елементів з грунту, про потребу рослин в основних елементах живлення на певних фазах розвитку та про якість сільськогосподарської продукції.
Проведення роботи. Мокре озонення. Відважують на торсійних терезах 200 мг тонкоподрібненого рослинного матеріалу, переносять у термостійку колбу місткістю 100 - 150 мл, доливають 5,5 мл суміші сірчаної і хлорної кислот (суміш готують безпосередньо перед спалюванням), добре перемішують і відстоюють ЗО—60 хв. За цей час вміст колби стає однорідним, темно-бурого кольору. Колбу закривають скляною пробкою, нагрівають спочатку на слабкому вогні 7—10 хв., а потім нагрівання підсилюють і продовжують на слабкому вогні 7—10 хв., а потім нагрівання підсилюють і продовжують до повного знебарвлення. Якщо темно-бура маса в колбі тривалий час не знебарвлюється, то після просвітління її вмісту масу охолоджують, додають 2—3 краплі хлорної кислоти і знову нагрівають. Знебарвлення настає через 5—10 хв.
Визначення загального азоту. 5 мл витяжки переносять у мірну колбу місткістю 100 мл (об'єм стяжки залежить від вмісту азоту в рослині і може змінюватися від 1 до 15 мл), доливають 2 мл 25 %-ї сегнетової солі і приблизно 75 мл дистильованої води, добре змішують, нейтралізують суміш у колбі кількома краплями 30%-го розчину NaOH (за лакмусом), не допускаючи надлишку лугу. Далі додають 2 мл реактиву Неслера, доводять об'єм у колбі до риски, ще раз перемішують і через 5 хв. колориметрують на фотоелектроколориметрі з синім світлофільтром. Вміст азоту обчислюють за формулою:

де С - кількість азоту (знайдено за калібрувальним графіком), мг;
у - вологість рослинного матеріалу,%;
100/100-у - коефіцієнт для перерахунку вмісту азоту на абсолютну суху речовину;
Н - розрахункова наважка, мг, яку визначають так:
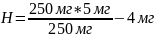
Знайшовши вміст загального або білкового азоту, обчислюють вміст «сирого» протеїну або протеїну:
«сирий» протеїн = азот загальний • К; протеїн = азот білковий-К (або білок), де азот загальний і азот білковий - процентний вміст відповідно загального і білкового азоту; К— коефіцієнт перерахунку вмісту азоту на «сирий» протеїн або білок, який для різних культур має своє значення (для озимої пшениці, жита, вівса, ячменю, гороху, бобів—5,7; для гречки, кукурудзи, квасолі -6,0; для соняшника, люпину, льону і коноплі—5,5).
Визначення фосфору. З мірної колби місткістю 250 мл піпеткою беруть 5—10 мл витяжки, переносять у мірну колбочку місткістю 60 мл, додають 5 мл 2,5 %-го розчину молібдату амонію, змішують і доливають 2 мл розчину сульфатгідразину, доводять до риски дистильованою водою, добре перемішують, кип'ятять 20 хв. на водяній бані, охолоджують і колориметрують.
Для виготовлення шкали із стандартним розчином проводять ті самі операції, що й з досліджуваним. Результати обчислюють за тією самою формулою, що й загальний азот.
Визначення калію. У витяжці, яка залишилась у колбі після визначення азоту і фосфору, калій визначають безпосередньо. З цією метою використовують полуменевий фотометр Г1ПФ-УНДІЗ або ін. Процентний вміст калію визначають так: за показами гальванометра і концентрацією К20 (мг/л) у стандартних розчинах будують графік, за яким знаходять концентрацію К20 (мг/л) в досліджуваних розчинах. Вміст калію (%) обчислюють за такою формулою:
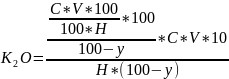
де С- концентрація К20, знайдена за калібрувальним графіком, мг/л;
Н - наважка, мг;
V - об'єм досліджуваного розчину;
У - вологість рослинного матеріалу, %.
Міністерство освіти і науки України
Криворізький технічний університет
Кафедра прикладної екології
