
- •1Лабораторна робота: Одержання каталізаторів глибокого окислення вуглеводів (метану) методом співосадження активних компонентів
- •1.1Стислі теоретичні відомості
- •1.2Експериментальна частина
- •1.3Методика розрахунку
- •2.2Експериментальна частина
- •2.3Методика розрахунку
- •3.2Експериментальна частина
- •3.3Методика розрахунку
- •4.2Експериментальна частина
- •4.3Методика розрахунків
- •5.2Експериментальна частина
- •6.2Експериментальна частина
- •6.3Обробка експериментальних даних
- •7.2Експериментальна частина
- •7.3Методика розрахунків
- •7.4Результати
- •7.5Висновки
- •8Лабораторна робота: Визначення загальної поруватості каталізатора
- •8.1Короткі теоретичні відомості
- •8.2Експериментальна частина
- •8.3Методика розрахунків
- •8.4Результати
- •8.5Висновки
- •9Лабораторна робота: Розрахунок кінетичних параметрів
- •I спосіб:
- •II спосіб:
3.2Експериментальна частина
Процес виготовлення каталізатора сітчастого типу можна поділити на наступні стадії:
Підготовчий етап:
підготовка розчину солі для електролізу;
підготовка сітки.
Електроліз.
Заключна обробка:
промивання;
сушіння;
прожарювання;
Експериментальна установка складається з джерела струму та власне електролізера. Схему експериментальної установки наведено на рисунку 3.1

1 – випрямляч, джерело струму; 2 – електролізер;3 – анод графітовий; 4 – катод металевий (сітка)
Рисунок 3.1 – Схема лабораторної установки
Виконання експерименту:
За допомогою лінійки і ножиць для металу вирізати зразок сітки 1х1 см.
Зразок сітки обробити розчином нітратної кислоти протягом 3 хвилин. Після обробки сітки не можна торкатися руками або забруднювати іншим чином.
Промити зразок сітки дистильованою водою, просушити на фільтрувальному папері та зважити на аналітичних терезах.
За вказівкою викладача приготувати розчин для електролізу необхідної концентрації. Об’єм розчину має бути достатнім для того щоб повністю покрити підготований зразок сітки у обраному хімічному стакані.
Розчин електроліту перенести у хімічний стакан – електролізер.
Помістити у електролізер з розчином графітовий анод та приєднати до позитивного затискача джерела струму.
Обережно приєднати зразок сітки до негативного затискача джерела струму та помістити його у розчин так, щоб він був повністю у нього занурений, але не торкався графітового аноду.
Ввімкнути напругу живлення та задати величину сили струму ~1А.
Проводити електроліз протягом 15 хвилин. Весь час контролювати силу струму.
Одержаний зразок обережно промити дистильованою водою.
Зразок просушити при температурі 423 К протягом 1 год.
Прожарювати зразок протягом 2 год. при температурі 1173 К.
Зважити зразок на аналітичних терезах.
3.3Методика розрахунку
Товщина шару каталізатора розраховується наступним чином:
![]()
де
![]() -
товщина шару каталізатора, см;
-
товщина шару каталізатора, см;
![]() -
діаметр дроту до осадження (відома
величина =
-
діаметр дроту до осадження (відома
величина =
![]() ),
см;
),
см;
![]() -
діаметр дроту після осадження, см;
-
діаметр дроту після осадження, см;
Необхідно знайти діаметр дроту після осадження, для цього порівняємо маси зразків до осадження і після.

![]() - маса
нанесеного (осадженого) металу, г
(знаходиться за різницею мас сітки до
та після електрохімічного осадження);
- маса
нанесеного (осадженого) металу, г
(знаходиться за різницею мас сітки до
та після електрохімічного осадження);
![]() - довжина
дроту сітки
- довжина
дроту сітки
![]() ;
;
![]() - кількість
горизонтальних плетінь;
- кількість
горизонтальних плетінь;
![]() - кількість
вертикальних плетінь;
- кількість
вертикальних плетінь;
1,3 – коефіцієнт, що враховує накладки при плетінні;
![]() - довжина
горизонтальних дротів, см;
- довжина
горизонтальних дротів, см;
![]() - довжина
вертикальних дротів, см.
- довжина
вертикальних дротів, см.
![]() - густина
нанесеного металу, г/см3;
- густина
нанесеного металу, г/см3;
Виходячи із цих залежностей розраховується діаметр дроту після нанесення металу та товщина шару покриття.
3.4Результати
3.5Висновки
4Лабораторна робота: Одержання активного оксиду алюмінію осадженням з розчину
Мета роботи: дослідження впливу умов одержання оксиду алюмінію та розрахунок виходу продукту.
4.1Короткі теоретичні відомості
Стійкі кристалічні форми оксиду алюмінію α-Al2O3, γ-Al2O3 знайшли широке застосування у виробництві адсорбентів та каталізаторів. Конверсія природного газу водяною парою, очищення викидних газів від оксидів азоту, гідрогенізація домішок сірки в природному газі, осушування газів – це далеко неповний перелік процесів, де використовується оксид алюмінію як носій каталізатора, каталізатор або адсорбент.
Поміж модифікацій Al(OH)3, найчастіше зустрічається гібсид (гідраргіліт), що входить до складу деяких бокситів, нордстрандит та байерит. Моногідроксид алюмінію відомий у двох модифікаціях діаспор α-AlOОН γ-AlOОН.
Залежно від кристалографічної структури оксиди алюмінію мають декілька модифікацій: α, γ, θ, δ та ін. Активний оксид алюмінію γ-Al2O3 має розвинену питому поверхню (120-150 м2/г), поруватість 50 – 70 % та високу міцність. Корунд α-Al2O3 – найбільш стійка форма оксиду алюмінію – є механічно та термічно міцним носієм, стійким до дії кислот та лугів. Поруватість його змінюється від 5 до 25 %, питома поверхня невелика (1 – 2 м2/г).
Оксиди алюмінію отримують дегідратацією різних гідроксидів. При проведенні дегідратації на повітрі послідовність стадій можна зобразити наступною схемою:

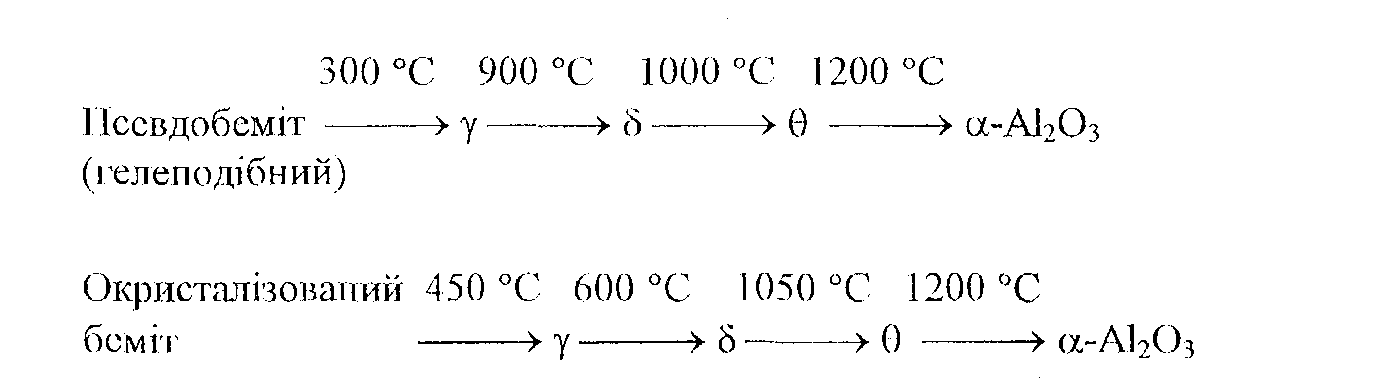
Таким чином, основною реакцією одержання активного оксиду алюмінію є дегідратація беміту. Умови осаджування гідроксидів, температура та час пропікання обумовлюють питому поверхню оксидів алюмінію.
Схематично метод одержання оксиду алюмінію має вигляд: розчинення солі алюмінію та осаджувача → старіння → промивання → грануляція → сушіння → пропікання. Вихідними розчинами можуть бути алюмінат натрію, азотнокисла або сірчанокисла солі алюмінію. Найбільш розповсюдженим осаджувачем є гідроксид амонію.
Осаджений при невисоких температурах гідроксид алюмінію є аморфним і демонструє картину погано викристалізованого беміту, так званого псевдобеміту. Одночасно з гідролізом основних солей алюмінію відбувається кристалізація гідроксиду. Хімічний склад, форма та розмір часток гідроксиду залежать від умов старіння: при підвищених температурах та високих рН утворюються порівняно великі (до 20 мкм) частки тригідрату-байериту. З підвищенням температури та рН під час старіння швидкість кристалізації гідроксидів підвищується, при цьому вона вища для псевдобеміту, ніж для байериту.
Осадження зі змінним рН (доливання розчину одного з компонентів у розчин іншого) сприяє утворенню суміші осадів різного складу. Осадження при постійному рН реалізується шляхом одночасного зливу розчинів реагентів у реактор з інтенсивним перемішуванням.
Осадження можна проводити у двох режимах: періодичному та безперервному.
В першому варіанті в процесі постійне тільки значення рН, концентрація осадів і солей в маточному розчині змінюється.
В другому варіанті всі параметри системи, а отже, склад осадів зберігається постійними протягом всього осадження завдяки безперервному відводу продуктів осадження. Встановлено, що осадження в безперервному режимі сприяє одержанню кристалічних осадів гідроксиду алюмінію з великою питомою поверхнею (до 200 м2/г), при цьому довге старіння не потрібне.
Перетворення псевдобеміту в γ-Al2O3 в інтервалі 573 – 1023 К не супроводжується значними змінами поверхні, тому питома поверхня γ-Al2O3, одержаного пропіканням псевдобеміту, є функцією поверхні вихідного матеріалу. Висока термостійкість такого оксиду алюмінію робить його цінним компонентом каталізаторів, що експлуатуються при температурах вище 673 К.
Використання гідроксиду байеритної структури як вихідного матеріалу дозволяє приготувати каталізатори з високою розвиненою поверхнею, але оксид алюмінію, одержаний з байериту, менш термостійкий, ніж одержаний із псевдобеміту.
