
Ассоциативная ионизация. Механизмы образования молекулярных ионов
Еще одним механизмом, играющим во многих случаях существенную роль, является ассоциативная ионизация, т.е. процесс, при котором две нейтральные частицы соединяются, образуя молекулярный ион и электрон:
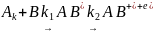 .
(6.36) Как нам уже
известно, реакции присоединения
завершаются только в том случае, когда
избыточная энергия тем или иным способом
отбирается от молекулы. В данной рекции
она может перейти в кинетическую энергию
разлетающихся частиц. Но наиболее
эффективно реакция протекает в том
случае, если одна или обе реагирующие
частицы находятся в возбужденном
состоянии, так что сумма их энергий
связи близка к энергии связи молекулярного
иона. Ассоциативная ионизация часто
является основным механизмом ионизации
на начальной стадии образования плазмы
в нагретом до высокой температуры
атомарном газе. Важным примером является
ионизация газа за фронтом ударной волны.
Реакция, обратная реакции ассоциативной
ионизации, называется диссоциативной
рекомбинацией.
Если энергия не передается в поступательные
степени свободы, то реакция (6.36) порисходит,
если молекулы имеют кинетическую энергию
,
равную или большую, чем разность энергий
ионазации и диссоциации молекулы АВ.
Это существенно меньше, чем энергия,
для ионизации атома. Например, для
ассоциативной ионизации азота и
кислорода, протекающей при высокой
температуре в воздухе,
.
(6.36) Как нам уже
известно, реакции присоединения
завершаются только в том случае, когда
избыточная энергия тем или иным способом
отбирается от молекулы. В данной рекции
она может перейти в кинетическую энергию
разлетающихся частиц. Но наиболее
эффективно реакция протекает в том
случае, если одна или обе реагирующие
частицы находятся в возбужденном
состоянии, так что сумма их энергий
связи близка к энергии связи молекулярного
иона. Ассоциативная ионизация часто
является основным механизмом ионизации
на начальной стадии образования плазмы
в нагретом до высокой температуры
атомарном газе. Важным примером является
ионизация газа за фронтом ударной волны.
Реакция, обратная реакции ассоциативной
ионизации, называется диссоциативной
рекомбинацией.
Если энергия не передается в поступательные
степени свободы, то реакция (6.36) порисходит,
если молекулы имеют кинетическую энергию
,
равную или большую, чем разность энергий
ионазации и диссоциации молекулы АВ.
Это существенно меньше, чем энергия,
для ионизации атома. Например, для
ассоциативной ионизации азота и
кислорода, протекающей при высокой
температуре в воздухе,
N + O + 2,8 эВ NO+ + e (6.37) разность энегий ионизации и диссоциации молекулы NO составляет лишь 2,8 эВ, тогда как для прямой ионизации молекулы электронным ударом требуется 9,25 эВ
NO + e + 9,25 эВ NO+ + e + e. (6.38) Если один из сталкивающихся атомов находится в возбужденном состоянии, то порог реакции понижается, а в ряде случаев может вообще отсутствовать (пенинговская ионизация).
Из вышеизложенного следует, что как ассоциативная, так и пенинговская ионизации приводят к образованию в низкотемпературной плазме молекулярных ионов. Следует особо подчеркнуть, что молекулярные ионы могут существовать даже в газах, не образующих стабильных нейтральных молекул. Например, в гелии, неоне и аргоне образуются молекулярные ионы с энергией диссоциации 2,24; 1,4 и 1,1 эВ соответственно (для сравнения: у молекулярных ионов водорода, углерода, кислорода и азота эта величина равна 2,65; 5,5; 6,7 и 8,7). Отсюда ясно, что для ассоциативной ионизации двух атомов гелия, находящихся в основном состоянии, находящихся в основном состоянии, потребовалась бы энергия, близкая к потенциалу ионизации атома, следовательно, в реакциях участвуют, в основном, возбужденные атомы
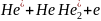 .
(6.39)
В
частности, для реакции He(11S0)
+ He(31P)
константа скорости реакции имеет весьма
высокое значение kas
=
8,310-10
см3/с.
.
(6.39)
В
частности, для реакции He(11S0)
+ He(31P)
константа скорости реакции имеет весьма
высокое значение kas
=
8,310-10
см3/с.
Другим важным источником молекулярных ионов в достаточно плотном газе является конверсия атомарных ионов в молекулярные в тройных столкновениях:
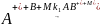 .
(6.40) При
термодинамическом равновесии из
константы равновесия следует соотношение
между плотностями атомарных и молекулярных
ионов:
.
(6.40) При
термодинамическом равновесии из
константы равновесия следует соотношение
между плотностями атомарных и молекулярных
ионов:
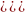 ,
(6.41) где
- приведенная масса ядер, а D
– энергия диссоциации молекулярного
иона. Видно, чем больше плотность газа
и ниже его температура, тем больше
образуется в плазме молекулярных ионов.
Особенно много их в распадающейся
плазме, где они и были впервые обнаружены.
,
(6.41) где
- приведенная масса ядер, а D
– энергия диссоциации молекулярного
иона. Видно, чем больше плотность газа
и ниже его температура, тем больше
образуется в плазме молекулярных ионов.
Особенно много их в распадающейся
плазме, где они и были впервые обнаружены.
Оценим константу скорости для реакции (6.40) в собственном газе
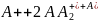 ,
(6.42) используя
формулу Томсона. При поляризационном
взаимодействии атома с ионом потенциальная
энергия взаимодействия равна U(r)
= - e2/2r4.
Характерный радиус взаимодействия
найдем, считая, что на этом растоянии
кинетическая энергия частицы (равная
по порядку величины температуре газа
Т)
равна потенциальной энергии взаимодействия
Т
~ e2/24.
Отсюда находим сечение поляризационного
взаимодействия:
,
(6.42) используя
формулу Томсона. При поляризационном
взаимодействии атома с ионом потенциальная
энергия взаимодействия равна U(r)
= - e2/2r4.
Характерный радиус взаимодействия
найдем, считая, что на этом растоянии
кинетическая энергия частицы (равная
по порядку величины температуре газа
Т)
равна потенциальной энергии взаимодействия
Т
~ e2/24.
Отсюда находим сечение поляризационного
взаимодействия:
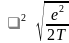 .
(6.43) Тогда
из формулы Томсона получим
.
(6.43) Тогда
из формулы Томсона получим
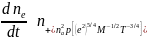 .
(6.44)
.
(6.44)
Величина в квадратных скобках есть томсоновская константа скорости образования молекулярных ионов kim в тройном стлкновении, а поправочный коэффициент р вводят для того, чтобы согласовать результат с экспериментальными данными и квантово-механическими расчетами. При р = 24 константа скорости обазования молекулярных ионов в благородных газах имеет весьма значение kim ~ 10-31 см6/с. Заметим, что молекулярные ионы образуются в высоковозбужденных (ридберговских) состояниях1. Для их стабилизации необходима последующая столкновительная или излучательная релаксация.
1Ридберговские состояния – высоковозбужденные состояния атомов, ионов и молекул с большими значениями главного квантового числа. Они имеют малую энергии связи и очень большое излучательное время жизни, и играют значительную роль во многих ступенчатых процессах.
Механизм диссоциативной рекомбинации.
Роль автоионизационных состояний
Естественно,
что при наличии в низкотемпературной
плазме большого числа молекулярных
ионов диссоциативная рекомбинация
может играть важную, а часто и определяющую
роль в ее кинетике. Высокая скорость
рекомбинации обусловлена тем, что,
будучи парным процессом, она не требует
третьей частицы для стабилизации
продукта. Как в прямом, так и обратном
процессах (6.36) важную роль играют
автоионизационные уровни нестабильного
промежуточного компонента
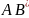 ,
который далее распадается, или
стабилизируется. На эффективность
стабилизации существенно влияет
распределение реагентов по возбужденным
состояниям и вид потенциальных кривых
молекулы АВ.
Имеются два типа взаимодействия
составляющих молекулу атомов, определяемых
строением электронной оболочки. Одни
образуют связанные состояния (кривые
с минимумом), другие – отталкивательные
состояния. Для атомов, не образующих
стабильные молекулы, связанные
молекулярные состояния при взаимодействии
атомов в основном состоянии вообще
могут отсутствовать, хотя не исключено
их существование для возбужденных
состояний.
,
который далее распадается, или
стабилизируется. На эффективность
стабилизации существенно влияет
распределение реагентов по возбужденным
состояниям и вид потенциальных кривых
молекулы АВ.
Имеются два типа взаимодействия
составляющих молекулу атомов, определяемых
строением электронной оболочки. Одни
образуют связанные состояния (кривые
с минимумом), другие – отталкивательные
состояния. Для атомов, не образующих
стабильные молекулы, связанные
молекулярные состояния при взаимодействии
атомов в основном состоянии вообще
могут отсутствовать, хотя не исключено
их существование для возбужденных
состояний.
Пусть
электрон, имеющий кинетическую энергию
е,
сталкивается с молекулярным ионом АВ+,
находящимся на одном из колебательных
уровней связанного состояния со средним
межатомным расстоянием
 .
Пусть для начала это основное колебательное
состояние (рис. 6.4).
.
Пусть для начала это основное колебательное
состояние (рис. 6.4).
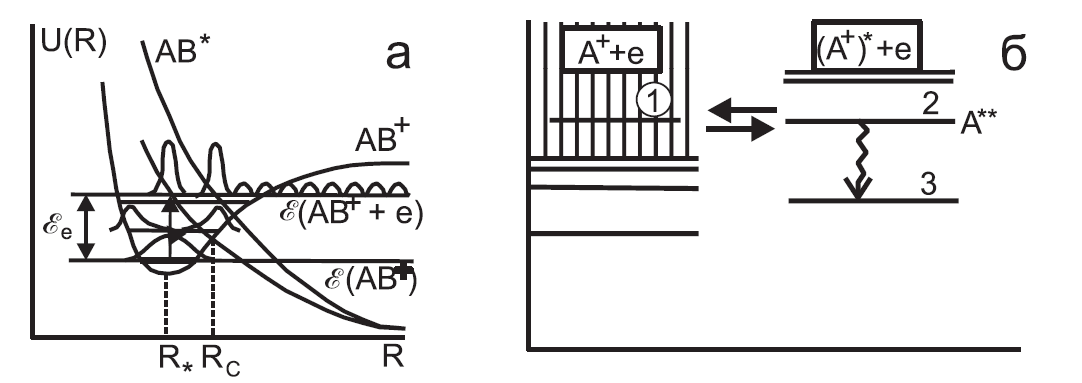
Рис. 6.4. Схема адиабатических электронных термов молекулы и молекулярного иона (а); Схема автоионизации и диэлектронной рекомбинации (б)
Во избежание недоразумений напомним, что потенциальная кривая определяется как функция межъядерного расстояния и не зависит от расстояния до налетающего электрона. Сблизившиеся ион и электрон образуют нейтральный промежуточный комплекс АВ+е- (АВ*), который имеет избыток энергии е и находится в автоионизационном состоянии. Для простоты, будем считать, что состояние нейтральной молекулы – отталкивательное. Автоионизационное состояние (рис. 6.4б) возникает, например, если в атоме (молекуле) одновременно два электрона сразу находятся на нестационарных орбитах. Такое состояние приводит либо к спонтанной автоионизации по каналу 2 1 (с появлением электрона в континууме), либо к переходу атома в однократно возбужденное состояние 2 3. Процесс 1 2 3 называется диэлектронной рекомбинацией. В атомной системе диэлектронная рекомбинация будет завершена, если А** успеет до обратного распада стабилизироваться за счет излучения кванта света или при соударении произойдет переход 2 3. Вероятность радиационной стабилизации, как мы помним, весьма мала. Для молекулы, как известно, имеется более эффективный механизм стабилизации – диссоциация молекулы, откуда и появилось название этого типа рекомбинации. Скорость диссоциативной рекомбинации существенным образом зависит от того, насколько благоприятно пересечение потенциальных кривых молекулы и молекулярного иона. Если кривая АВ* имеет вид, представленный на рис. 6.4а пунктиром, то волновая функция состояния нейтральной молекулы в континууме (также обозначенная пунктиром) при энергии электрона е хорошо перекрывается с волновой функцией связанного состояния иона в основном колебательном состоянии и сечение захвата электрона в состояние АВ* велико. Если же потенциальная кривая для АВ* имеет вид, обозначенный сплошной линией, то вероятность захвата электрона с энергией е ионом в основном состоянии мала. Однако если АВ+ находится в первом возбужденном колебательном состоянии, то перекрытие снова становится хорошим, но теперь для электронов с энергией е1 = е - , где - энергия колебательного состояния молекулы.
Захвата электрона, однако, еще недостаточно для завершения процесса рекомбинации. Образовавшаяся в отталкивательном состоянии нейтральная молекула начинает разлетаться. Пока ядра не разошлись на расстояние, большее Rc, сохраняется вероятность автоионизации с частотой авто [1/с]. После разлета на расстояние, больше чем Rc, обратный распад молекулы на электрон и ион становится не возможен. Из рис. 6.4а очевидно, что электроны с энергией, существенно меньшей, чем е, имеют малую вероятность захвата, и в процессе диссоциативной рекомбинации не участвуют. Из сказанного также ясно, что и распределение молекулярных ионов по колебательным состояниям существенно влияет на скорость рекомбинации.
Скорость диссоциативной рекомбинации
АВ+ + е АВ** А + В* (6.45) определяется очевидным выражением
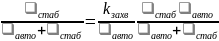 .
(6.46) Мы знаем, что в
процессе реакции (6.45) равновесие может
быть сдвинуто влево или вправо. В первом
случае
.
(6.46) Мы знаем, что в
процессе реакции (6.45) равновесие может
быть сдвинуто влево или вправо. В первом
случае
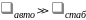 и
мы имеем
и
мы имеем
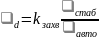 ,
(6.47) т.е. узкое
место – стабилизация продукта распада.
Поскольку в этом случае
,
(6.47) т.е. узкое
место – стабилизация продукта распада.
Поскольку в этом случае
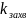 и
и
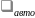 находятся в состоянии термодинамического
равновесия
находятся в состоянии термодинамического
равновесия
 .
(6.48) Если
.
(6.48) Если
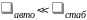 ,
то узкое место – захват электрона. В
результате каждый захват ведет к
рекомбинации и ее скорость
,
то узкое место – захват электрона. В
результате каждый захват ведет к
рекомбинации и ее скорость
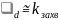 (6.49)
весьма велика.
(6.49)
весьма велика.
Диссоциативная рекомбинация определяет объёмную нейтрализацию заряженных частиц в низкотемпературной плазме молекулярных газов, а также в плазме атомарных газов достаточно высокого давления (р > 10 Тор) при умеренных температурах тяжёлых частиц (до ~ 1000°K), когда преобладающим сортом положительно заряженных частиц являются молекулярные ионы. Зависимость коэффициента диссоциативной рекомбинации от температуры электронов Те и температурыры газа Т имеет вид:
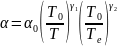 ,
где γ1
1, γ2
0,5
,
где γ1
1, γ2
0,5
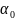 - значение коэф. при Те
= Т =
Т0
=
295°K.
Обычно
один из атомов, образующихся в результате
диссоциативной Р., оказывается сначала
в возбуждённом состоянии, а затем
переходит в невозбуждённое, спонтанно
излучая. Это излучение служит источником
информации о механизме диссоциативной
Р., а также о состоянии молекулярных
ионов в плазме.
- значение коэф. при Те
= Т =
Т0
=
295°K.
Обычно
один из атомов, образующихся в результате
диссоциативной Р., оказывается сначала
в возбуждённом состоянии, а затем
переходит в невозбуждённое, спонтанно
излучая. Это излучение служит источником
информации о механизме диссоциативной
Р., а также о состоянии молекулярных
ионов в плазме.
Состояние продуктов диссоциативной рекомбинации
При диссоциативной рекомбинации выделяется энергия
Q = I - ,
где I – потенциал ионизации атома, – энергия связи молекулярного иона. В случае инертных газов эта энергия оказывается очень большой. Например, молекулярному иону аргона достаточно для диссоциации получить 1,4 эВ
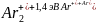 ,
,
тогда как его потенциал ионизации составляет 15,8 эВ
Ar + 15,8 эВ Ar+ + e.
Если бы после диссоциативной рекомбинации оба атома аргона оказались в основном состоянии, их кинетическая энергия составила бы 14,4 эВ. Однако в атомно-молекулярных реакциях выполняется общее правило: вероятность трансформации внутренней энергии в кинетическую очень мала. Поэтому при диссоциативной рекомбинации один из образующихся атомов, как правило, оказывается в возбужденном состоянии. Следовательно рекомбинация является одним из механизмов, ответственных за появление в плазме возбужденных атомов и связанного с ними линейчатого излучения плазмы.
Для сильно связанных молекулярных ионов ситуация оказывается иной, чем описано выше. Например, для молекулы азота энергия связи довольно высока
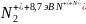
и составляет более половины потенциала ионизации атома
N + 14,5 эВ N+ + e.
В этом случае вероятность образования невозбужденных продуктов существенно выше.
