
- •Химическая технология
- •Содержание
- •Введение
- •1. Порядок прохождения лабораторного практикума
- •1.1. Правила и приемы безопасной работы в лаборатории
- •1.1.1. Токсикологическая характеристика веществ, применяемых в практикуме
- •1.1.2. Требования безопасности перед началом работы
- •1.1.3. Требования безопасности во время работы
- •1.1.4. Требования безопасности в аварийной ситуации
- •1.1.5. Требования безопасности по окончании работы
- •1.1.6. Требования пожарной безопасности
- •1.1.7. Характеристика пожарной опасности применяемых веществ
- •1.2. Отчет о лабораторной работе
- •1.2.1. Оформление и представление отчета
- •2.1.2. Методика проведения работ по «варке» гипса
- •2.2.2. Методика выполнения работы
- •Контрольные вопросы
- •2.3.2. Методика проведения работы
- •2.4.2. Методика проведения работы
- •2.5.2. Методика проведения работы Вариант I
- •Вариант II
- •Контрольные вопросы
- •2.6.2. Методика проведения работ Вариант 1
- •Инструкция к лабораторной работе
- •Вариант 2
- •2.7.2. Методика проведения работы
- •2.7.3. Испытание защитных свойств фосфатной пленки
- •Инструкция к лабораторной работе «Фосфатирование металлов»
- •2.8.2. Методика проведения работы Вариант I – объемный метод определения скорости коррозии в электролитах
- •Вариант II – гравиметрический метод определения скорости коррозии металлов в кислых средах
- •2.9.2. Методика проведения работы
- •Контрольные вопросы и задачи
- •Список литературы
- •2.10. Лабораторная работа «получение амиачной селитры»
- •2.10.1. Краткие теоретические сведения
- •2.10.2. Порядок выполнения работы
- •2.10.3. Анализ аммиачной селитры на содержание аммонийного азота
- •2.11.2. Схема установки и порядок выполнения работы
- •2.11.3. Анализ щелоков производства гидроксида натрия «Определение общей щелочности»
- •2.12.2. Методики проведения работы
- •Контрольные вопросы
- •Литература
- •Заключение
- •Химическая технология
- •1 56961, Г. Кострома, ул. 1 Мая, д. 14
2.4.2. Методика проведения работы
Оборудование и реактивы: сушильный шкаф, аналитические весы, тигельные щипцы, эксикатор, микрошпатель, пронумерованные бюксы, CuSO4–5H2O перекристаллизованный, растертый и высушенный на воздухе.
Опыт проводится тремя студентами. Каждый студент имеет
два пронумерованных бюкса.
1. Взвешивание бюксов. Возьмите два бюкса, поставьте их в сушильный шкаф при 90–92°С и выдержите в шкафу 30 минут.
Выньте бюксы из шкафа, поставьте в эксикатор для охлаждения до комнатной температуры и взвесьте с точностью до 0,001 г.
2. Взвешивание бюксов с веществом. В каждый из двух бюксов поместите по 1 г CuS04 5H20, взвесьте на аналитических весах с точностью до 0,001 г, поставьте бюксы, полузакрытые крышками, в сушильный шкаф при 90–92°С и выдержите в течение указанного ниже времени
№ бюкса |
время, мин |
1 |
10 |
2 |
20 |
3 |
30 |
4 |
40 |
5 |
80 |
6 |
120 |
По окончании нагревания поставьте бюксы в эксикатор до полного охлаждения и затем взвесьте. Запишите результаты опыта по следующей форме.
№ бюкса |
Температура, t, °С |
Масса бюкса, г |
Масса бюкса с навеской до опыта, г |
Навеска, г |
Масса бюкса с навеской после опыта, г |
Умень-шение массы навеки, г |
Относительные потери массы навески, % |
|
|
|
b0 |
B1 |
b1–b0 |
b2 |
b1– b2 |
(
(b1–b0)
|
· 100 |
Из данных, полученных тремя студентами, постройте по шести точкам кривую зависимости уменьшения массы навески от времени.
Такая кривая называется кинетической кривой, которая для реакций термического разложения имеет s-образный вид (рис. 2.4.1). Для этого отложите на оси абсцисс время в минутах в масштабе 1 мм = 1 мин, а на оси ординат процент потери массы в масштабе 1 мм = 0,1 %.
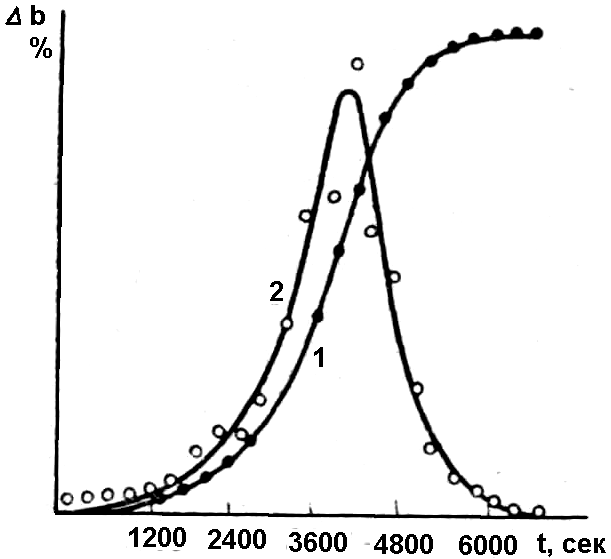
Рис. 2.4.1. Кинетика реакций термического разложения твердых фаз:
1 – зависимость потери в весе от времени; 2 – зависимость скорости
реакции от времени
Проведите анализ кинетической кривой. Установите время различных периодов реакции дегидратации: начала реакции, хода реакции, окончания реакции. Укажите время, когда дегидратация практически закончилась. Постройте кривую зависимости скорости реакции дегидратации от времени. Для этого отложите на оси абсцисс время в минутах, а на оси ординат Δb /Δt,
где Δb – потеря массы, а Δt – интервал времени. Для реакций термического разложения такая кривая имеет вид (рис. 2.4.1). Проведите анализ полученной из опыта кривой. Укажите время периодов изменения скорости дегидратации: роста скорости, достижения максимума, уменьшения скорости.
Контрольные вопросы
Какие реакции называют реакциями в твердых фазах?
Почему дегидратация кристаллогидратов относится к реакциям в твердых фазах?
Что такое кинетические кривые?
Можно ли из кинетической кривой установить время окончания реакции?
Почему скорость дегидратации кристаллогидратов идет через максимум?
Список литературы
Соколовский А.А. Технология минеральных удобрений и кислот / А. А. Соколовский, Е. В. Яшке. – М. : Химия, 1979. – 306 с.
Сулименко Л. М. Технология минеральных вяжущих материалов и изделий на их основе : учебник. – 3-е изд., перераб. и доп. – М. : Высш. шк., 2000. – 304 с.
2.5. ЛАБОРАТОРНАЯ РАБОТА
«ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ КОНТАКТНЫМ СПОСОБОМ»
2.5.1. Краткие теоретические сведения
Получение серной кислоты контактным способом включает следующие стадии: 1) получение сернистого газа; 2) очистка сернистого газа; 3) окисление сернистого газа до серного ангидрида; 4) улавливание серного ангидрида серной кислотой.
В лаборатории обжиг серного колчедана и сжигание серы проводят в токе кислорода, так как при использовании воздуха обжиговый газ содержит пониженное количество сернистого ангидрида. Очистка сернистого газа, имеющая большое значение в промышленности, в лабораторных условиях может быть ограничена сушкой концентрированной серной кислотой.
Окисление, протекающее по уравнению реакции:
2SO2 + O2<=>2SO3 + Q,
идет с уменьшением объема газов и выделением теплоты. Например, при 450 °С на 1 моль выделяется 22 660 кал. Для повышения скорости окисления двуокиси серы применяют катализатор — пятиокиcь ванадия.
При большой скорости окисления катализатор нагревается, что смещает равновесие реакции в сторону распада серного ангидрида, поэтому в промышленности применяют отвод теплоты от катализатора. В лаборатории можно применять значительные количества катализатора, заполнив им трубку, и пропускать газ с небольшой скоростью. В этих условиях перегрева катализатора не происходит и можно создавать оптимальный температурный режим окисления с большим выходом серного ангидрида. Так, при 450 °С степень контактирования сернистого газа доходит до 97,6 %.
Для поглощения серного ангидрида в промышленности используется серная кислота с массовой долей 98,3 %, так как давление паров воды над ней минимальное. Если же для поглощения применять воду, то серный ангидрид, находящийся в газовой смеси, дает с парами воды туман, который водой не поглощается. Но в лабораторных условиях, когда требуется определить выход серной кислоты или доказать ее наличие, используется вода, в которой растворяется часть серного ангидрида. Выходящий из поглотителя туман серной кислоты можно уловить мокрым фильтром из стеклянной ваты или электрофильтром.

 b1–b2)
b1–b2)