
- •Химическая технология
- •Содержание
- •Введение
- •1. Порядок прохождения лабораторного практикума
- •1.1. Правила и приемы безопасной работы в лаборатории
- •1.1.1. Токсикологическая характеристика веществ, применяемых в практикуме
- •1.1.2. Требования безопасности перед началом работы
- •1.1.3. Требования безопасности во время работы
- •1.1.4. Требования безопасности в аварийной ситуации
- •1.1.5. Требования безопасности по окончании работы
- •1.1.6. Требования пожарной безопасности
- •1.1.7. Характеристика пожарной опасности применяемых веществ
- •1.2. Отчет о лабораторной работе
- •1.2.1. Оформление и представление отчета
- •2.1.2. Методика проведения работ по «варке» гипса
- •2.2.2. Методика выполнения работы
- •Контрольные вопросы
- •2.3.2. Методика проведения работы
- •2.4.2. Методика проведения работы
- •2.5.2. Методика проведения работы Вариант I
- •Вариант II
- •Контрольные вопросы
- •2.6.2. Методика проведения работ Вариант 1
- •Инструкция к лабораторной работе
- •Вариант 2
- •2.7.2. Методика проведения работы
- •2.7.3. Испытание защитных свойств фосфатной пленки
- •Инструкция к лабораторной работе «Фосфатирование металлов»
- •2.8.2. Методика проведения работы Вариант I – объемный метод определения скорости коррозии в электролитах
- •Вариант II – гравиметрический метод определения скорости коррозии металлов в кислых средах
- •2.9.2. Методика проведения работы
- •Контрольные вопросы и задачи
- •Список литературы
- •2.10. Лабораторная работа «получение амиачной селитры»
- •2.10.1. Краткие теоретические сведения
- •2.10.2. Порядок выполнения работы
- •2.10.3. Анализ аммиачной селитры на содержание аммонийного азота
- •2.11.2. Схема установки и порядок выполнения работы
- •2.11.3. Анализ щелоков производства гидроксида натрия «Определение общей щелочности»
- •2.12.2. Методики проведения работы
- •Контрольные вопросы
- •Литература
- •Заключение
- •Химическая технология
- •1 56961, Г. Кострома, ул. 1 Мая, д. 14
2.3.2. Методика проведения работы
Оборудование и реактивы
Два фарфоровых или стеклянных стакана на 200–250 мл.
Мешалка.
Термометр.
Воронка для горячего фильтрования.
Раздробленный сильвинит или искусственная смесь эквивалентных количеств хлористого калия и натрия.
Технические весы с разновесом.
Мензурка на 100–150 мл.
Раствор кобальтнитрита натрия.
ПРОВЕДЕНИЕ РАБОТЫ
Растворение сильвинита проводится в стакане, снабженном стеклянной мешалкой и термометром (рис. 2.3.2). Выщелачивание сильвинита проводится щелоком. Для его получения отвешивают в стакане 50 г сильвинита, наливают 100 мл воды, нагревают до кипения и после перемешивания стеклянной палочкой охлаждают.
Холодный раствор декантируют с выпавшего осадка в стакан, в который добавляют 50 г сильвинита, и смесь при перемешивании нагревают до 100°С. Затем раствор отделяют от осадка через воронку для горячего фильтрования.
Можно также горячий раствор быстро профильтровать через воронку Бухнера с отсосом. Для фильтрования можно применить обычный бумажный фильтр. Оставшуюся смесь солей сдают лаборанту. Охлаждают раствор до 25°С, выпавший осадок хлористого калия отфильтровывают через воронку с пористой стеклянной пластинкой или через бумажный фильтр, осадок высушивают и взвешивают. Для анализа продукта отвешивают на аналитических весах 0,1–0,2 г соли, растворяют ее в 10–12 мл воды, подкисляют 1–2 мл уксусной кислоты и приливают раствор кобальтнитрита натрия до прекращения выделения желтого осадка K2Na[Co(N02)6] Н20.
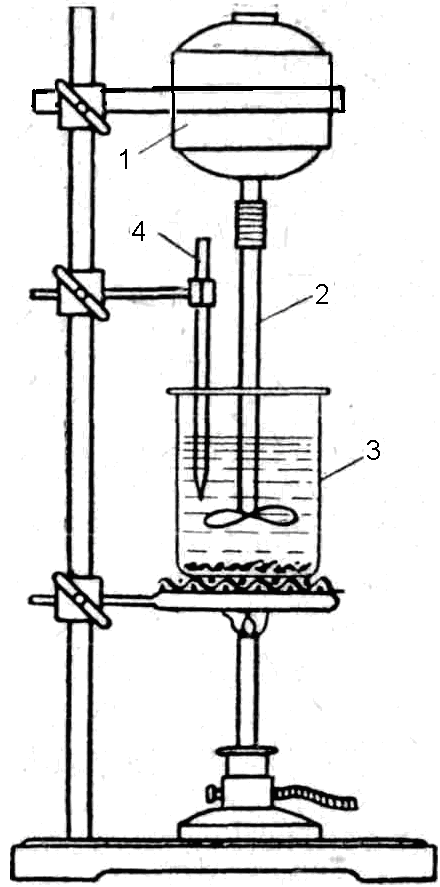
Рис. 2.3.2. Растворение сильвинита:
1 – мотор; 2 – мешалка; 3 – стакан; 4 – термометр
Фильтруют
осадок через фильтровальный тигель или
через воронку с пористой пластинкой и
асбестовым волокном. Осадок промывают сначала 10 % раствором
уксусной кислоты до появления бесцветного
фильтрата, а затем спиртом. Осадок
высушивают при 110 °С,
взвешивают и рассчитывают процентное
содержание
хлористого
калия во взятой навеске. Аналитический
фактор для определения количества
хлористого калия по весу K2Na[Co
(N2)
6]
· Н2O
= 0,1642.
На основании количества полученного
хлористого калия и количества взятого
сильвинита рассчитывают выход хлористого
калия.
Осадок промывают сначала 10 % раствором
уксусной кислоты до появления бесцветного
фильтрата, а затем спиртом. Осадок
высушивают при 110 °С,
взвешивают и рассчитывают процентное
содержание
хлористого
калия во взятой навеске. Аналитический
фактор для определения количества
хлористого калия по весу K2Na[Co
(N2)
6]
· Н2O
= 0,1642.
На основании количества полученного
хлористого калия и количества взятого
сильвинита рассчитывают выход хлористого
калия.
Фильтрат, оставшийся после отделения хлористого калия, можно использовать в дальнейших работах по выщелачиванию хлористого калия из сильвинита. Количество солей, перешедших в раствор, определяют теоретическим путем на основании количества взятой воды и растворимости солей. Количество хлористого калия рассчитывается на основании результатов анализа и общего веса полученного осадка солей.
Результаты опыта оформляют в виде таблицы.
Масса воды, г
|
Масса солей, г |
Выпало солей из раствора, г |
Выход соли, %
|
||
КС1 |
NaCl |
КС1 |
NaCl |
||
|
|
|
|
|
|
Контрольные вопросы
Что обозначают точки В1, В2, В3 на изотермах совместной растворимости NаСI и КСI?
Нарисуйте изотермы совместной растворимости NаСI и КСI при 50 и 75 ºС.
Список литературы
Кутепов А. М. и др. Общая химическая технология. – М. : Академкнига, 2005. – 528 с.
Ключников Н. Г. Практические занятия по химической технологии. 4-е изд. – М. : Просвещение, 1978. – 262 с.
2.4. ЛАБОРАТОРНАЯ РАБОТА
«КИНЕТИКА РЕАКЦИЙ ДЕГИДРАТАЦИИ В ТВЕРДЫХ ФАЗАХ»
Цель работы – изучение кинетики реакций в твердых фазах на примере дегидратации пятиводного сульфата меди.
2.4.1. Краткие теоретические сведения
Реакции в твердых фазах — это реакции, протекающие при непосредственном взаимодействии между частицами твердых веществ, а также реакции окисления, восстановления и термического разложения твердых фаз.
Особенность этих реакций в том, что процесс протекает на поверхности соприкосновения взаимодействующих фаз. Вследствие локализации в пределах реакционной зоны скорость процесса пропорциональна величине реакционной зоны в каждый данный момент времени. В первый момент, как только образовались центры реакции, скорость процесса невелика, но увеличивается по мере их роста.
Возникающие на начальных центрах участки реакционной зоны могут распространяться независимо друг от друга или пересекаться с образованием единого фронта реакции. Последнее соответствует максимальной скорости, после чего площадь реакционной зоны начинает сокращаться и скорость уменьшается. Процессы взаимодействия твердых веществ относятся к диффузионно-химическим процессам. Их скорость зависит от скорости реакции и от скорости диффузии и определяется скоростью наиболее медленной стадии – процесса диффузии реагирующих веществ через слой продуктов реакции.
В зависимости от температуры реакция протекает по уравнениям:
CuSO4 5Н2O = CuSO4 ЗН2O + 2Н2O при 50–95 °С;
CuSO4 ЗН2O = CuSO4 Н2O + 2Н2O при 100 °С и выше;
CuSO4 Н2O = CuSO4 + H2O при 200 °С и выше.
