
- •1)))))) Кинетическая энергия ,потенициальная энергия .Закон сохранения механической энергии.
- •2)))))) Упругие деформации.Закон Гука.
- •3)))))) Импульс. Закон сохранения импульса.
- •4)))))) Закон всемирного тяготения. Сила тяжести. Вес тела.
- •5)))))Взаимодействие тел. Первый закон Ньютона. Инерциальная система отсчёта.
- •6)))))) Сила.Масса.Второй закон Ньютона.
- •7)))))) Третий Закон Ньютона.Принцип относительности Галлилея.
- •8))))) Электрический заряд. Элементарный заряд. Закон сохранения электрич. Заряда.
- •9))))) Взаимодействие точечных зарядов. Закон кулона.
- •10))))))) Электрический ток в газах. Самост. ,несамост. Разяды. Плазма.
- •11)))) Действие магнитного поля на проводник с током. Закон Ампера.
- •12))))))) Колебательный контур. Свободные электромагнитные колебания в контуре. Формула Томсона.
- •13))))) Магнитный поток. Явление электромагн. Индукции.
- •14)))Электрический ток в электроликах. Законы электролиза,применение.
- •15)))))Электрический ток в полупроводниках и примесная проводимость полупроводников.
- •16)))) Идеальный газ. Изотермический,изобарный, изохорный процессы в идеальном газе.
- •17)))))) Идеальный газ . Основное уравнение мкт идеального газа.
- •18)))) Внутренняя энергия. Колиество теплоты. Работа в термодинамике. Применение к изопроцессам.
- •19))))) Принцип действия тепловых машин, тепловые двигатели, кпд тепловых двигателей.
- •21)))) Опыты Резерфорда. Ядерная модель атома.
- •22)) Квантовые постулаты Бора. Изучение поглащения света атомом.
- •23))) Интерференция сфета.
- •24))))) Фотоэффект. Эксперементальные законы внешнего фотоэффекта. Уравнение Энштейна для фотоэффекта.
- •25)))))) Радиактивность. Закон радиоктивного распада.
- •26))))) Ядерные реакции. Ципные ядерные реакции. Ядерный реактор.
- •27))) Строение и свойства жидкостей. Поверхностное натяжение.
17)))))) Идеальный газ . Основное уравнение мкт идеального газа.
В основе МКТ лежит объяснение строения и свойств макроскопических тел в результате взаимодействия большого числа атомов молекул и ионов.
В основе МКТ лежат 3 положения:1. Все вещества состоят из мельчайших частиц – молекул; 2. Молекулы находятся в непрерывном хаотичном тепловом движении; 3. Между молекулами действуют силы, которые в зависимости от расстояния являются силами притяжения или отталкивания.
М – относительная атомная масса
1 моль – количество вещества, в котором содержится столько же молекул или атомов, сколько в 0,012 кг углерода NА = 6,02 * 10 23 1/моль (число Авогадро) (постоянная)
Количество
вещества –
это число молей в данной порции вещества,
которое равно отношению числа молекул
в веществе к числу Авогадро: 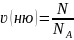
Молярной массой называют массу некоторого количества вещества, взятого в количестве одного моля М = mо NA
mo (масса одной молекулы)
mo = m/N = m/V(ню)*NА = М/ NА
Идеальный газ —модель газа, которая по своим свойствам напом. реальные одноатомные газы, это модель газа потенциальной энергией молекул которого можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой упруги.
В модели идеального газа приняты следующие допущения:1. Размеры молекул малы по сравнению со средним расстоянием между ними, моле6кулы можно принимать за материальные точки; 2. Силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударении; 3. Молекулы сталкиваются друг с другом как абсолютно упругие шары, движение которых описывается законами механики.
Основное уравнение МКТ – уравнение Клаузиуса: p (давление) = 1/3nm <V2>
<V2> - средняя квадратичная скорость
n – концентрация = N/V = N/ℓS = (число мол.)/(объем) = (число мол.)/ (площадь осн. * высоту)
<Eк> = <mV2>/2 = m*<V2> /2 (кинетическая энергия)
p = (2/3)*n*<Eк>
При нормальных атмосферных условиях (н.у) :t = 0 oC ; p = 105 Па; V = 22,4 * 10-3 м3
Уравнение состояния идеального газа - формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Открыта Менделеевым из гипотезы Авогадро. Уравнение имеет вид:
R![]() – универсальная газовая постоянная.
R=8,31
Дж/моль*К
– универсальная газовая постоянная.
R=8,31
Дж/моль*К
18)))) Внутренняя энергия. Колиество теплоты. Работа в термодинамике. Применение к изопроцессам.
Внутренняя энергия вещества – это сумма кин. энергии теплового хаотического движ. всех молекул и пот. энергии их взаимод. Внутренняя энергия является функцией состояния, т.е. данному состоянию газа соответствует вполне определённая внутренняя энергия.
Для идеального газа внутренняя энергия - это кинетическая энергия теплового движения всех молекул.
Д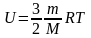 ля
одноатомного идеального газа внутренняя
энергия
ля
одноатомного идеального газа внутренняя
энергия
Д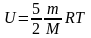 ля
двухатомного идеального газа внутренняя
энергия(m-масса газа, M-молярная масса,
T-температура,
R=8,31
(Дж/моль * К)-унив. газовая постоянная)
ля
двухатомного идеального газа внутренняя
энергия(m-масса газа, M-молярная масса,
T-температура,
R=8,31
(Дж/моль * К)-унив. газовая постоянная)
Таким образом, внутренняя энергия зависит от температуры и числа молекул.
Изменить внутреннюю энергию можно: 1) путём совершения работы самой газовой системой или внешними силами над системой; 2) путём теплопередачи (теплообмена). Существует три вида теплообмена: 1) теплопроводность – процесс теплообмена при непосредственном контакте двух тел; 2) конвекция – перенос теплоты потоками жидкости или газа; 3) тепловое излучение – перенос теплоты посредством электромагнитных волн.
Работа газа (А) - одна из форм обмена энергией (наряду с теплотой) термодинамической системы (физ. тела) с окружающими телами. Определяется формулой А=Р V, где Р –давление газа, V=(V2-V1) – изменение объёма.
 Чтобы
рассчитать работу графически нужно
взять точки 1,2,V1
,V2
Чтобы
рассчитать работу графически нужно
взять точки 1,2,V1
,V2
Газ выполняет работу только в процессе изменения своего объёма. При расширении V0 газ совершает положительную работу, а внешние силы А=-А отрицательную. При сжатии газа V0 газ совершает отрицательную работу, а внешние силы – положительную.
При изобарном процессе работа А= Р V;
При изохорическом работа А=0;
П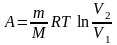 ри
изотермическом работа
ри
изотермическом работа
Количество теплоты Q – это мера изменения внутренней энергии в процессе теплообмена. Если тело нагревается, то Q0, если тело охлаждается, то Q0.
Количество теплоты, необходимое для нагревания тела массой m от температуры Т1 до температуры Т2 рассчитывается по формуле
Q=cm(T2-T1)=cmT, где с – удельная теплоёмкость вещества.
Удельная теплоёмкость вещества с – это количество теплоты, которое необходимо сообщить телу массой 1 кг, чтобы нагреть на 1 К.
Первый закон термодинамики: количество теплоты в сообщенной системе расходуется на увеличение ее внутренней энергии и на работу, совершаемую системой против внешних сил.
∆Q=∆ʊ+A
Изменение внутренней энергии системы равно сумме сообщенного ей количества теплоты и работы, произведенной над системой внешними силами.
Применение к изопроцессам:
T=const |
Q=A |
При изотерм. пр. всё сообщённое системе кол-во теплоты расх. на сов. работы |
P=const |
Q=V+A |
При изобарном процессе кол. тепл. в сообщ. системе расход. на изменение внутр. энергии и на сов. системой работы |
V=const |
Q=V |
При изотерм. процессе всё сообщ. газу кол. теплоты расх. на имен. внутр. энергии. |
Адиобатным наз. Процесс ,идущий без обмена теплотой между системой и окруж. средой.
Q=0 A= -V
При сов. системой работы адиабатного расширения, внутр. энергия убывает. Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой.
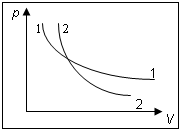 1-
изотерма, 2-адиобата
1-
изотерма, 2-адиобата
