
- •1)))))) Кинетическая энергия ,потенициальная энергия .Закон сохранения механической энергии.
- •2)))))) Упругие деформации.Закон Гука.
- •3)))))) Импульс. Закон сохранения импульса.
- •4)))))) Закон всемирного тяготения. Сила тяжести. Вес тела.
- •5)))))Взаимодействие тел. Первый закон Ньютона. Инерциальная система отсчёта.
- •6)))))) Сила.Масса.Второй закон Ньютона.
- •7)))))) Третий Закон Ньютона.Принцип относительности Галлилея.
- •8))))) Электрический заряд. Элементарный заряд. Закон сохранения электрич. Заряда.
- •9))))) Взаимодействие точечных зарядов. Закон кулона.
- •10))))))) Электрический ток в газах. Самост. ,несамост. Разяды. Плазма.
- •11)))) Действие магнитного поля на проводник с током. Закон Ампера.
- •12))))))) Колебательный контур. Свободные электромагнитные колебания в контуре. Формула Томсона.
- •13))))) Магнитный поток. Явление электромагн. Индукции.
- •14)))Электрический ток в электроликах. Законы электролиза,применение.
- •15)))))Электрический ток в полупроводниках и примесная проводимость полупроводников.
- •16)))) Идеальный газ. Изотермический,изобарный, изохорный процессы в идеальном газе.
- •17)))))) Идеальный газ . Основное уравнение мкт идеального газа.
- •18)))) Внутренняя энергия. Колиество теплоты. Работа в термодинамике. Применение к изопроцессам.
- •19))))) Принцип действия тепловых машин, тепловые двигатели, кпд тепловых двигателей.
- •21)))) Опыты Резерфорда. Ядерная модель атома.
- •22)) Квантовые постулаты Бора. Изучение поглащения света атомом.
- •23))) Интерференция сфета.
- •24))))) Фотоэффект. Эксперементальные законы внешнего фотоэффекта. Уравнение Энштейна для фотоэффекта.
- •25)))))) Радиактивность. Закон радиоктивного распада.
- •26))))) Ядерные реакции. Ципные ядерные реакции. Ядерный реактор.
- •27))) Строение и свойства жидкостей. Поверхностное натяжение.
13))))) Магнитный поток. Явление электромагн. Индукции.
При движении проводника в магн. поле с ним перемещ. свободные заряды(электроны),если цепь разомкнуть,то созданная разность потенциалов и будет наз. ЭДС электромагн. индукции.
Явление электромагнитной индукции- это явление возникновения ЭДС индукции в проводнике движущийся в постоянном магнитном поле .(это явление было открыто Фарадеем в 1831 г.)
Существование ЕДС- индукции приводит к появлению в амкнутом контуре индукционного тока, ктоторый будет нагревать проводник.
![]() (В-магн.
индукция)
(В-магн.
индукция)
ЭДС индукции возник. в движущимся проводнике, определяется его длиной и модулем движ. магнит. поля.
Магнитный поток(Φ) – это склярная физическая величина харак-ся числом линий магнитной индукции поля пронизывающий замкнутый контур.
Φ = B · S · cos α ( Вб) (S-площадь контура, a-угол между B и норм. пов.)
Велечину
магн. потока можно истолковать,как
величену,пропорциональную числу линий
магн. индукции пер. поверхность.
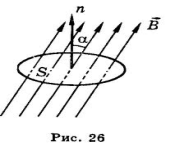
Магн. поток в 1 вебер создаётся однородным магнитным полем с индукцией в 1 Тл через плоскую поверхность площадью в 1 м(квадратный) размещённой перпендикулярно вектору электромагн. индукции.
14)))Электрический ток в электроликах. Законы электролиза,применение.
Электролитическая диссоциация – распад молекул в-ва на ионы при растворении его в жидкости, а сам раствор явл электролитом, способным проводить электрический ток.
Ими явл не только растворы но и расплавы в-в,кристаллы которых построены из ионов.
Носителями тока явл ионы и проводимость наз ионной.
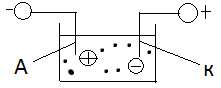
Под действием сил электр.поля заряенные частицы начинают движение в электролите: положительные ионы(аноды) движутся к катоду и наз. катионы, а отриц заряженные к аноду и наз анионы.
На электродах ионы получают не достающий заряд и становятся нейтральными атомами, а катионы получают электроны с катода(восстанавливаются), анионы отдают избыток электронов аноду(окисляются).
Электрический ток в жидкостях представляет собой направленное движение ионов.
При прохождении тока через электролит происходит хим реакция на электродах в результате кот, выделяются хим элементы входящие в состав электролита- электролиз. В результате электрлиза на катоде выделяются металлы или водород, а на аноде остаток хим соединения.
1883-84 гг Майкл Фарадей экспериментально установил законы электролиза.
1
закон Фарадея:масса
в-ва, выделяющегося на каком либо из
электродов прямопропорциональна заряду
прошедшему через электролит.
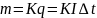
К(кг/Кл)-электрохим эквивалент в-ва численно равен массе в-ва, выделившегося на электроде при прохождении заряда в 1 Кл
2
Закон Фарадея:Электрохим
эквивалент пропорционален хим эквиваленту
данного в-ва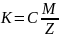 C=1/F
F-постоянная
фарадея=96500 Кл/моль
C=1/F
F-постоянная
фарадея=96500 Кл/моль
С-коэффициент пропорциональности , который имеет одинаковое значение для всех в-в.
П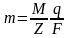 рименение
электролиза:
рименение
электролиза:
1)в электрометаллургии для получения чистых щелочных и щелочноземельных металлов; 2) для очистки металлов от примесей; 3) в гальваностегии для покрытия металлов защитным слоем (никелирование, хромирование); 4)в гальванопластике для изготовления рельефных металлических копий предметов. 5)полиграфия-получ. копий с матриц 6)для получ. отслаемывых поерхностей(метод Гальвино Пластино)7)для получ. алюминия из бакситов
