
- •Ветеринарная вирусология, ее достижения и задачи.
- •Вирионы - наиболее известная форма существования вирусов.
- •Вирусы как инфекционные агенты. Принципиальные отличия вирусов от других инфекционных агентов.
- •Генетические признаки вирусов и их использование в характеристике штаммов. Мутации у вирусов и их механизмы.
- •Действие на вирионы вирусов различных температур, уфл, кислот, щелочей, спиртов, дезинфектантов, окислителей и восстановителей, жирорастворителей, антибиотиков.
- •Диагноз на основе анализа клинических симптомов, патологоанатомических изменений и эпизоотологических данных.
- •18. Инактивированные вакцины.
- •19. Живые вакцины.
- •Значение вирусов для решения общебиологических проблем.
- •Индикация вирусов в патологическом материале по обнаружению вирионов и вирусных телец-включений.
- •Индикация, выделение и идентификация вирусов.
- •Обнаружение ( индикация) вируса в материале;
- •Иммуноферментный анализ. Достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Использование в вирусологии лабораторных животных. Устройство вивариев, правила техники безопасности при работе с лабораторными животными.
- •Масса животных в разном возрасте
- •Температура тела, пульс и число дыханий у здоровых животных
- •Состав крови некоторых лабораторных животных (по в.Н.Никитину)
- •Использование в вирусологии культур клеток. Типы культур клеток. Получение клеточных культур.
- •Клеточный геном и реализация генетической информации в нормальной клетке.
- •Клеточный и гуморальный противовирусный иммунитет, их взаимодействие.
- •Принципы культивирования вирусов.
- •Методика титрования и расчёта титра вируса в оое и бое, в единицах 50%-го инфекционного действия.
- •Методы уничтожения, инактивации и консервации вирусов.
- •Механизм персистенции вирусов в клетках.
- •Неспецифические факторы противовирусной защиты организма.
- •Окончательный диагноз на основе обнаружения и идентификации вирусов в организме больных животных.
- •Обнаружение ( индикация) вируса в материале;
- •Особенности противовирусного иммунитета.
- •Открытие вирусов и история их изучения.
- •Патогенез вирусных болезней животных.
- •Персистенция вирусов. Роль факторов иммунитета на этапах патогенеза вирусной болезни.
- •Получение патологического материала, его транспортировка.
- •2.1 Получение и обработка патологического материала
- •2.2 Получение патологоанатомического материала
- •2.3 Получение проб для гистологического исследования.
- •2.4 Транспортировка и хранение проб.
- •Понятие о титре вируса. Единицы количества вируса: оое, бое, лд, ид, элд, эид, цпд, гае. Выражение в них титра вирусов.
- •Понятия о гене и геноме вирусов. Вирусная популяция, вирусный штамм, вирусный клон.
- •Правила работы с вируссодержащими материалами.
- •1.1 Техника безопасности и правила работы с вируссодержащим материалом
- •Получение и транспортировка патологического материала для вирусологических исследований.
- •Устройство вирусологической лаборатории.
- •Превращение вирусологии в одну из фундаментальных биологических наук.
- •Принципы диагностики вирусных болезней животных.
- •Природа вирусов, их место и роль в биосфере. Роль вирусов в эволюции жизни на Земле.
- •Вирусы играют эволюционную роль.
- •Пути проникновения вирусов в организм животного. Первичная локализация и циркуляция вируса.
- •Вторичная циркуляция вируса. Механизм повреждающего действия вирусов на клетки.
- •Полимеразная цепная реакция, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Реакция диффузной преципитации в агаровом геле. Достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Реконвалесценция, вирусоносительство и вирусовыделение.
- •Репродукция вирионов вирусов.
- •Реакция иммунной флуоресценции, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Реакция нейтрализации, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Реакция непрямой гемагглютинации, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Роль вирусов в инфекционной патологии животных, растений и человека.
- •Реакция связывания комплемента, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Реакция торможения гемагглютинации, достоинства и недостатки реакции и области возможного применения в вирусологии.
- •Использование в вирусологии реакции гемадсорбции.
- •Серологическая диагностика вирусных болезней по приросту титра антител в парных сыворотках крови.
- •Систематика вирусов. Принцип систематики, ее научная и практическая ценность.
- •Основные критерии таксономической классификации вирусов
- •Специфическая профилактика вирусных болезней животных.
- •Специфические факторы противовирусного иммунитета и их формирование.
- •Структура и химический состав вирионов вирусов.
- •Типы вирусных геномов. Структурные (вирионные) и неструктурные белки вирусов, их свойства и отличия от клеточных белков, их функции.
- •Вирусные геномы. Виды вирусных геномов.
- •Трансляция и образование структурных и неструктурных вирусных белков. Сборка вирионов и их выход из клеток.
- •Титрование вирусов.
- •Ферменты вирионов, липиды и углеводы в составе вирионов.
- •3.1. Белки вирусов
- •3.2. Липиды вирусов
- •3.3. Углеводы вирусов
- •Формы взаимодействия вирионов с клетками.
- •Формы и размеры вирионов. Типы симметрии вирионов и их обусловленность. Нуклеиновые кислоты вирусов, их функции и отличия от клеточных нуклеиновых кислот.
- •Экономический ущерб, наносимый животноводству вирусными болезнями животных.
- •Вирусы гриппа птиц и ньюкаслской болезни и их дифференциация в ртга.
- •Вирус африканской чумы однокопытных.
- •Вирус африканской чумы свиней.
- •Вирус болезни Ауески.
- •Вирус болезни Тешена.
- •Вирус инфекционного бронхита кур.
- •Вирус инфекционного бурсита кур.
- •Вирус контагиозного пустулезного дерматита овец и коз.
- •Вирус чумы крупного рогатого скота.
- •1. Определение болезни
- •3. Возбудитель болезни
- •4. Эпизоотология
- •5. Патогенез
- •6.Течение и клиническое проявление
- •7. Патологоанатомические признаки
- •8. Диагностика и дифференциальная диагностика
- •9. Иммунитет, специфическая профилактика
- •10. Профилактика
- •11. Лечение
- •12. Меры борьбы
- •Вирусы гриппа.
- •1. Грипп птиц.
- •2. Грипп свиней.
- •3. Грипп лошадей.
- •Вирусы энцефаломиелитов лошадей.
- •Вирус миксоматоза кроликов.
- •Вирус геморрагической болезни кроликов.
- •Прионы и прионные инфекции животных.
- •6.1. Общая характеристика прионов и прионных инфекций
- •6.1. Основные различия нормальной и патогенной форм прионного белка
- •6.2. Прионные инфекции животных
- •6.3. Скрепи
- •6.4. Энцефалопатия норок
- •Медленные вирусные инфекции.
- •Вирус Алеутской болезни норок.
- •Вирус чумы плотоядных.
- •Вирус инфекционной анемии лошадей.
- •Вирус парагриппа-3.
- •Аденовирусы крупного рогатого скота.
- •Вирусы лейкозов.
- •Вирус болезни Марека.
- •Вирусы респираторно-репродуктивного синдрома свиней и парвовирусной инфекции свиней.
- •Парвовирусная инфекция свиней
- •Вирус бешенства.
- •Лабораторная диагностика бешенства.
- •Лабораторная диагностика лейкоза крс.
- •5.6. Число лейкоцитов и лимфоцитов у здорового, подозрительного по заболеванию и больного лейкозом крупного рогатого скота («лейкозный ключ»)
- •Лабораторная диагностика оспы.
- •Лабораторная диагностика ящура.
Состав крови некоторых лабораторных животных (по в.Н.Никитину)
Вид животных |
Гемоглобин г% |
Число эритроцитов, млн /мл |
Число лейкоцитов |
Лейкоцитарная формула |
|||||||
|
|
|
|
Базофилы |
Эози- нофи- лы |
Мие- лоци- ты |
Юные |
Пало- чко- ядер- ные |
Сег-мен-то-ядер-ные |
Лимфоциты |
Моноциты |
Собака |
80 |
6,5 |
9 |
1,0 |
6 |
- |
- |
3,0 |
58,0 |
25,0 |
7,0 |
Овца |
68 |
9,4 |
8,2 |
0,6 |
4,5 |
- |
- |
1,2 |
33,0 |
57,7 |
3,0 |
Кошка |
90 |
7,0 |
18 |
- |
4,0 |
- |
- |
6,0 |
52,0 |
37,7 |
2,1 |
Кролик |
70 |
5,0 |
8 |
5,0 |
1,0 |
- |
- |
- |
30,0 |
60,0 |
4,0 |
Морская свинка |
100 |
5,0 |
12,0 |
0,1 |
6,0 |
- |
- |
0,5 |
35,0 |
53,4 |
5,0 |
Крыса белая |
11О |
6,0 |
15,0 |
- |
2,0 |
- |
- |
- |
30,0 |
67,0 |
1,0 |
Мышь белая |
100 |
9,0 |
13,0 |
0,5 |
- |
- |
- |
2,0 |
36,0 |
60,0 |
0,5 |
Курица |
75 |
3,5 |
36,0 |
3,0 |
4,0 |
- |
- |
0,25 |
36,0 |
50,0 |
6,75 |
Голубь |
93 |
4,0 |
10,4-31,4 |
2,0 |
1,5 |
- |
- |
- |
- |
55,5 |
34,9 |
Лягушка |
52 |
0.38 |
2,4-39,1 |
23,0 |
6,0 |
- |
|
- |
|
44,5 |
38,3-39,1 |
Проявлению каннибализма в значительной мере способствуют посторонние запахи, приобретаемые новорожденными в ходе манипулирования с ними экспериментатора Новорожденных животных следует брать только прокипяченным пинцетом Экспериментатор должен работать в перчатках, с которых смыты следы антисептика (йода, фенола и др.) Заражать новорожденных животных лучше на весу или на толстом слое стерильной фильтровальной бумаги.
В группу для проведения опыта подбирают животных с одинаковыми показателями массы, температуры, состава крови и т. д. (табл. 1-3). От этого в значительной степени зависит успех выделения, титрования и пассирования вируса. При этом учитывают восприимчивость животных к различным вирусам Отобранных животных метят, распределяют по банкам или клеткам, отмечают дату постановки опыта, его номер, заражающую или профилактическую дозу препарата и, если необходимо, как мечены животные Последнее важно, когда в одной банке или клетке находятся животные нескольких групп.
4.5 Техника безопасности при работе с лабораторными животными. Прежде всего, сотрудники должны быть защищены от естественных инфекционных болезней животных и от воспроизводимых на них экспериментальных инфекций, возбудители которых патогенны для человека.
Наиболее часто встречается среди лабораторных животных такая естественная инфекция, как сальмонеллез. Заразившиеся люди переносят заболевание в гастроинтестинальной или тифоподобной (генерализованной) форме. Опасность для людей представляют также листериоз, псевдотуберкулез, туберкулез, туляремия.
Поскольку многие инфекционные болезни животных протекают в бессимптомной персистирующей форме, животных необходимо периодически обследовать.
Источником инфицирования людей могут служить экспериментально зараженные животные и их эктопаразиты. Профилактика заражения людей от животных проводится с учетом возможного пути передачи данного возбудителя. Состояние здоровья сотрудников лаборатории находится под медицинским контролем с учетом особенностей инфекции, с возбудителем которой работают сотрудники.
При работе в лаборатории с вирусами бешенства, клещевого энцефалита, инфекционного гепатита и некоторыми другими инфекциями сотрудникам делают прививки против этих болезней. В случае необходимости проводят экстренную профилактику специфическим иммуноглобулином или сывороткой реконвалесцентов. Одновременно осуществляют весь комплекс противоэпидемических мероприятий, необходимый при данной инфекционной болезни.
4.6 Метка лабораторных животных. Метка является непременным условием использования животных в эксперименте. На клетке, в которой помещены зараженные животные, укрепляют бирку с надписью, отражающей использованный для заражения вирус (или номер экспертизы исследуемого патологического материала), количество зараженных животных, дату заражения и, если надо, другие сведения.
Для животных разных видов применяют разные способы индивидуальной метки. Для крупных животных и кур используют металлические бирки со штампованным номером. Бирки надевают на корень уха (кроликам), вставляют в ушную раковину по типу серьги (морским свинкам), надевают на ногу – окольцовывают (курам).
При использовании в эксперименте небольшой группы животных и при непродолжительном сроке его можно выстригать шерсть знаками на спине, бедрах (у кроликов). Морских свинок можно различать по окраске, которую регистрируют в рабочем журнале.
Метка белых мышей, белых крыс может быть проведена ампутацией отдельных пальцев на передних или задних конечностях, каждый из которых соответствует тому или другому порядковому номеру: на передних лапах – единицам, на задних – десяткам. Однако чаще пользуются методом нанесения цветных пятен на непигментированную шерсть. Насыщенный раствор пикриновой кислоты лучше других красителей (растворов фуксина, бриллиантовой зелени) удерживается на шерсти и коже животных. Цветные метки ставятся в местах, соответствующих определенному порядковому номеру животного. Так, если тело животного мысленно разделить на три продольные части (левый бок, спина, правый бок), то нанесение цветных пятен начинают с левого верхнего угла, т. е. лопатки, и это будет соответствовать 1 (рис. 8). Тогда, двигаясь назад, левый бок соответствует 2, а левое бедро – 3, далее затылок – 4, спина – 5, область репицы – 6, правое плечо – 7, правый бок – 8, правое бедро – 9. Используя два цвета красителей, можно дать обозначения одним из них – единиц, другим – десятков.

Рисунок 8. Метка лабораторных животных
Использование в вирусологии куриных эмбрионов. Строение куриного эмбриона.
.1 Достоинства и недостатки куриных эмбрионов как биологических объектов. Культивирование вирусов в куриных эмбрионах – наиболее доступный и удобный метод как для первичного выделения вирусов от больных животных и из объектов внешней среды, так и для последующего культивирования вирусов в лаборатории. Этот метод широко применяется для идентификации вирусов и антител, а также для приготовления вакцин и диагностикумов. Практика применения показала ряд преимуществ этого метода перед культивированием вирусов на лабораторных животных. Известно, что белые мыши, которых широко используют при вирусологических исследованиях, могут быть спонтанно заражены рядом вирусных инфекций: эктромелией, лимфоцитарным хориоменингитом, энцефалитом Тейлора, вирусной пневмонией, вирусом Сендай и другими, что крайне осложняет работу и нередко приводит к ошибочным выводам при оценке получаемых результатов. Культивирование вирусов на куриных эмбрионах в значительной мере устраняет указанные выше трудности. Наряду с этим от куриного эмбриона можно получить значительно большее количество вируса, чем от лабораторных животных. Куриный эмбрион обладает большей жизнеспособностью и устойчивостью к разного рода воздействиям, неизбежным при введении исследуемого материала. При известном навыке работы с эмбрионами и соблюдении правил асептики гибель их незначительна. Наибольший отход эмбрионов бывает при введении материала в амниотическую полость и желточный мешок, но и в этих случаях она не превышает 10–15%, если соблюдены необходимые условия инкубирования.
Куриные эмбрионы как живая система вошли в вирусологическую практику в 30-х годах XX в. Их использование расширило спектр культивируемых в лабораторных условиях вирусов, позволило более успешно решать стоящие перед вирусологией задачи в связи с тем, что куриные эмбрионы имеют ряд преимуществ перед лабораторными животными: 1)скорлупа и подскорлупная оболочка надежно защищают эмбрион от бактериального заражения со стороны внешней среды; 2) важным преимуществом эмбрионов является также их высокая чувствительность к широкому спектру вирусов, что объясняется недостаточным развитием защитных механизмов; 3) куриные эмбрионы легкодоступный объект в связи с развитием широкой сети птицефабрик и инкубаториев; 4) куриные эмбрионы экономичны, не требуют ухода и кормления.
Основными недостатками являются: 1) невозможность полностью гарантировать стерильность этой живой системы, так как эмбрионы могут нести в своем содержимом вирусы и другие патогенные агенты (вирусы инфекционного бронхита кур, ньюкаслской болезни, гриппа, лейкоза, хламидии и микоплазмы). Их присутствие может искажать результаты исследования; 2) куриные эмбрионы чувствительны не ко всем вирусам.
7.2 Цели использования куриных эмбрионов. Используют куриные эмбрионы в вирусологии в основном для тех же целей, что и лабораторных животных, а именно:
– обнаружения в патматериале активного вируса биопробой;
– первичного выделения вируса. Эффективно выделяют и культивируют на куриных эмбрионах вирусы, вызывающие заболевания у птиц, а также некоторые вирусы млекопитающих;
– поддержания вирусов в лаборатории;
– титрования вирусов;
– накопления вируса для лабораторных исследований и получения вакцин;
– как тест-объект в реакции нейтрализации.
7.3 Требования к куриным эмбрионам. Яйца необходимо получать из благополучных по вирусным болезням хозяйств. В оплодотворенных яйцах даже от клинически здоровых кур могут находиться различные встречающиеся у этих птиц вирусы: ньюкаслской болезни, инфекционного бронхита, инфекционного ларинготрахеита, энцефаломиелита, парагриппа-2, полиартрита, оспы, арбовирусы, аденовирусы и др. Присутствие этих вирусов может, с одной стороны, привести к диагностическим ошибкам, а с другой, на основе явления интерференции, – к подавлению размножения вируса, находящегося в исследуемой пробе. Эмбрионы, не содержащие вируса, но полученные от кур, бессимптомно зараженных определенными вирусами, также могут быть менее чувствительны или абсолютно нечувствительны к действию данного вируса благодаря наличию специфических антител, полученных от матери с желтком. Для удачного выделения вируса необходимо, чтобы куры, эмбрионы которых используют в работе, не были вакцинированы против болезни, возбудителя которой ищут. Скорлупа яиц должна быть непигментированной, чистой (мыть нельзя). Возраст эмбриона должен соответствовать избранному методу заражения.
Для обеспечения нормального развития зародышей в оплодотворенных яйцах в период инкубации необходимо соблюдать определенную температуру и влажность. Развивающиеся эмбрионы переносят перегрев значительно хуже, чем охлаждение. Поэтому кратковременная (в течение нескольких часов) поломка в системе обогрева не приносит большого вреда. При более длительном перерыве необходим подогрев.
Инкубируемые яйца нуждаются в свободном доступе свежего воздуха, который поступает через отдушины. Они должны быть всегда открытыми. Одно яйцо, как принято считать, расходует 1 л кислорода в день, что неудивительно, если вспомнить о бурном развитии зародыша в течение 21 дня инкубации. Именно поэтому яйца нельзя класть вплотную, а также одно на другое. Для инкубации яиц непригодны обычные термостаты. Лишь в случае крайней необходимости их можно использовать для этих целей, но при этом часто проветривать и поставить внутрь сосуд с водой для обеспечения требуемой влажности.
Заложенные на инкубацию яйца через 3–5 дней просвечивают с помощью специальной настольной или ручной (если яйца не вынимают из лотка инкубатора) лампы, чтобы отобрать неоплодотворенные. Наиболее удобны для вирусологических работ яйца леггорнов, так как их тонкая белая скорлупа позволяет лучше рассмотреть содержимое. Неоплодотворенные или содержащие погибших зародышей яйца из инкубатора удаляют. Доля оплодотворенных яиц колеблется в значительных пределах в зависимости от многих факторов, в том числе от времени года: весной она самая высокая, зимой самая низкая.
Второй раз зародыши просвечивают в день запланированного заражения. Срок этот зависит от вида вируса, а также пути его введения. На скорлупе обычным (не чернильным) карандашом отмечают место заражения.
7.4 Строение куриного эмбриона. Обычно курица откладывает оплодотворенное яйцо, в котором зародыш находится на стадии бластулы или ранней гаструлы. При нагревании яйца до температуры, близкой к температуре тела курицы, происходит дальнейшее развитие зародыша (рис. 14). В период с 5-го по 12-й день инкубации куриные эмбрионы могут быть использованы для заражения вирусами.
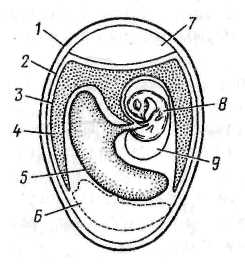
Рисунок 11.Схематический разрез куриного эмбриона на 8-й день инкубации: 1 – скорлупа; 2 – подскорлупная оболочка; 3 – хорионаллантоисная оболочка; 4 – аллантоисная полость; 5 – желточный мешок; 6 – белок; 7 – воздушная камера; 8 – тело зародыша; 9 – амниотическая полость
Яйцо с развивающимся куриным эмбрионом покрыто снаружи твердой пористой скорлупой, к которой плотно прилегает подскорлупная оболочка. Последняя в тупом конце яйца разделяется на два листка, между которыми образуется воздушная камера. Тело зародыша лежит в яйце эксцентрично, спиной ближе к скорлупе, голова направлена в сторону воздушной камеры. Зародыш погружен в околоплодную жидкость, заполняющую амниотическую полость, и пуповиной связан с желтком. Желток также располагается эксцентрично и относительно зародыша как бы по другую сторону продольной оси.
Непосредственно под подскорлупной оболочкой находится аллантоисная полость, покрывающая амнион и желточный мешок, а к 10-11-му дню замыкающаяся в остром конце яйца. В процессе развития аллантоисная оболочка срастается с хорионом, образуя единую хорионаллантоисную оболочку (ХАО). В остром конце яйца находится остаток белка.
Заражение в ту или другую часть эмбриона проводится в период ее максимального развития, когда количество чувствительных клеток будет наибольшим.
В процессе инкубации меняются размеры зародышевых структур, что во многом объясняется их функциональным назначением и определяет оптимальный для заражения возраст эмбриона.
Так, желточный мешок как резервуар питательных веществ имеет наибольший объем в начале инкубации, а затем (после 12-го дня) по мере развития зародыша он уменьшается. Заражают в желточный мешок с 5-го по 7-й день инкубации.
Амниотическая полость, являясь буферной средой развития зародыша, покрывает его уже на 5-й день инкубации. Среднее количество жидкости к середине периода инкубации составляет около 1 мл.
Для заражения в амниотическую полость используют эмбрионы в возрасте 6-10 дней.
Аллантоисная полость служит для сбора продуктов обмена, в ней скапливаются мочекислые соли, фосфорные и азотистые соединения. В процессе роста и развития зародыша аллантоисная жидкость приобретает кислую реакцию. Максимальных размеров аллантоисная полость достигает на 9-12-й день развития эмбриона, поэтому заражение в аллантоисную полость проводят преимущественно на 9-11-й день инкубации.
Хорионаллантоисная оболочка богата кровеносными сосудами, которые, тесно прилегая к внутренней поверхности пористой скорлупы, насыщаются кислородом и снабжают им тело зародыша, выполняя функцию органа дыхания эмбриона. Максимального развития ХАО достигает на 11-13-й день. Заражение на хорионаллантоисную оболочку проводят на 10-12-й день инкубации.
7.5 Подготовка куриных эмбрионов к заражению. Эмбрионы доставляют из инкубатория, не допуская их охлаждения в пути. В лаборатории эмбрионы инкубируют в термостате при температуре 37 °С и влажности 60-70 %, что достигается установлением в термостате открытых широкогорлых сосудов с водой. Вентиляционные отверстия термостата должны быть открыты. Эмбрионы размещают воздушной камерой вверх в специальных штативах. Рекомендуется до момента заражения дать возможность эмбрионам в течение суток адаптироваться к новым условиям и нормализовать свои функции после транспортного стресса. Если лаборатория располагает собственным инкубаторием, то снесенные курицей оплодотворенные яйца пригодны для закладки в него в течение 10 дней.
Подготовка куриных эмбрионов к заражению включает овоскопирование и дезинфекцию скорлупы, а также соответствующую подготовку рабочего места. Овоскопирование представляет собой просмотр яиц против достаточно яркого источника света (овоскоп), в результате чего на неосвещенной стороне скорлупы образуются тени от внутренних структур (рис. 15). Овоскопирование проводят в затемненном помещении. При этом на скорлупе графитным карандашом отмечают границу воздушной камеры, место расположения зародыша и участок бессосудистой зоны размером 0,5x0,5 см. Эти отметки служат ориентиром при выборе места введения вируссодержащего материала. При овоскопировании также определяют, жив зародыш или погиб. Зародышей, проявляющих активные движения при хорошей кровенаполненности сосудов ХАО, считают живыми.

Рисунок 12. Овоскопирование куриного эмбриона на 10-е сутки инкубации. Видны тени:
1 – зародыша; 2 – желточного мешка; 3 – кровеносных сосудов ХАО; 4 – воздушной камеры; 5 – белка
Куриные эмбрионы заражают в асептических условиях (лучше в боксе). В предбокснике скорлупу эмбрионов обрабатывают йодированным спиртом, затем уже в боксе повторно протирают, а иногда еще и фламбируют – обрабатывают пламенем смоченного спиртом тампона.
Эмбрионы фиксируют в специальных подставках, установленных в эмалированной кювете на 3–4-слойной марлевой салфетке, смоченной дезинфицирующим раствором.
В работе используют инструменты, стерилизованные кипячением. Их ставят в баночку со спиртом и обжигают пламенем горелки перед каждым повторным использованием.
