
- •7. Сучасні уявлення про будову атома. Поняття про квантові числа. Принципи Паулі, Гунда, правило Клечковського.
- •3.Відносна атомна і молекулярна маса. Методи визначення.
- •5. Розчини та їх класифікація. Місце ро-нів серед складн. Речовин. Розчинність. Концентрація.
- •24.Загальна характеристика та хімічні властивості елементів родини Феруму.
- •15. Загальна характеристика галогенів, їх фізичні та хім.Властивості. Соляна кислота та її солі.
- •14. Гідроген, оксиген ─ фізичні і хімічні властивості. Методи добування ті застосування.
- •23.Загальна характеристика та хімічні властивості елементів підгрупи Алюмінію.
- •16. Загальна характеристика елементів підгрупи сульфуру. Сульфатна кислота.
- •10.Валентність елементів.
- •18. Найважливіщі сполуки фосфору. Фосфорна к-та.
- •1.Основні стехіометричні закони хімії
- •6.Основні класи неорганічних сполук.
- •11.Періодичний закон і періодична система елементів
- •21.Метали, їх розташування в періодичній системі. Хімічні властивості.
- •12.Основні типи хімічних зв’язків у сполуках. Мвз, ммо.
- •13.Загальна характеристика неметалів.
- •22.Характеристика та хімічні властивості металів і і іі груп.
- •19.Загальна характеристика елементів IV групи головної підгрупи. Карбон, його фізичні та хімічні властивості. Неорганічні сполуки карбону.
- •25.Корозія металів, методи захисту від корозії.
- •26.Загальна характеристика лантаноїдів та актиноїдів.
5. Розчини та їх класифікація. Місце ро-нів серед складн. Речовин. Розчинність. Концентрація.
Розчин─ однорідна суміш 2-х і більшого числа молекулярних або йонних речовин, компоненти не можна відрізнити неозброєним оком (гомогенна система, яка складається з 2-х і більше речовин). Класифікація:
За розчинником (водні і неводні)
За провідністю (електроліти і неелектроліти)
За класом розчиненої речовини (ро-ни кислот, основ і солей)
За концентрацією (насичені, ненасичені, пересичені)
За агрегтним станом ( тверді, рідкі, газуваті)
Розчинність ─ маса речовини, що розчиняється в 100 г розчинника при даних умовах.
Конц.─ безрозмірна або розмірна величина, яка виражає співвідношення компонентів у розчині.
масова частка
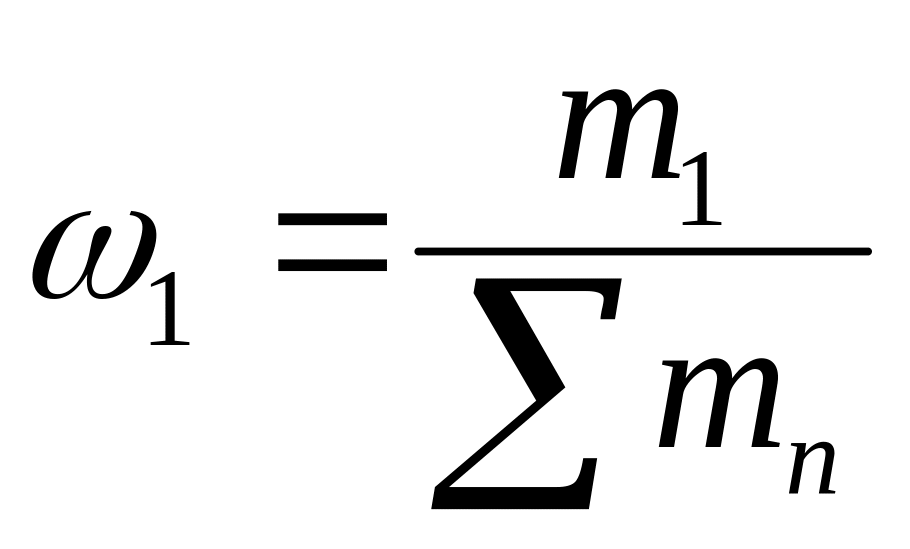 ,
якщо 2 компонента,
,
якщо 2 компонента,
то:![]()
молярність розчину
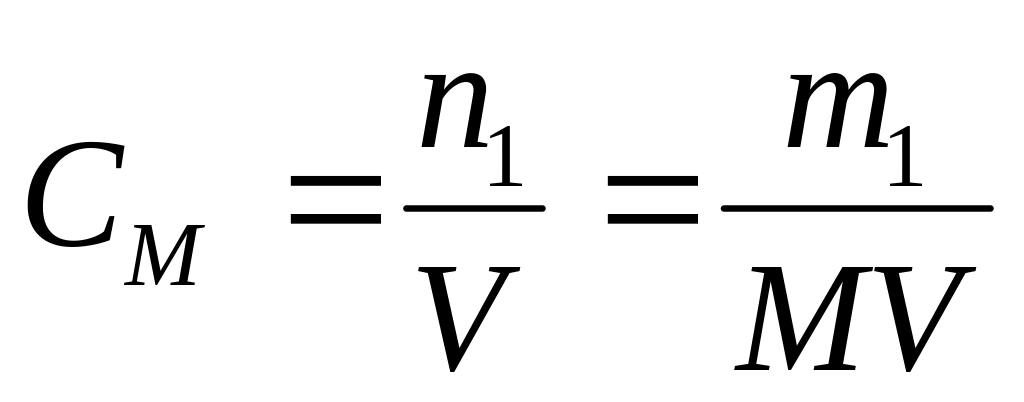
моляльність розчину
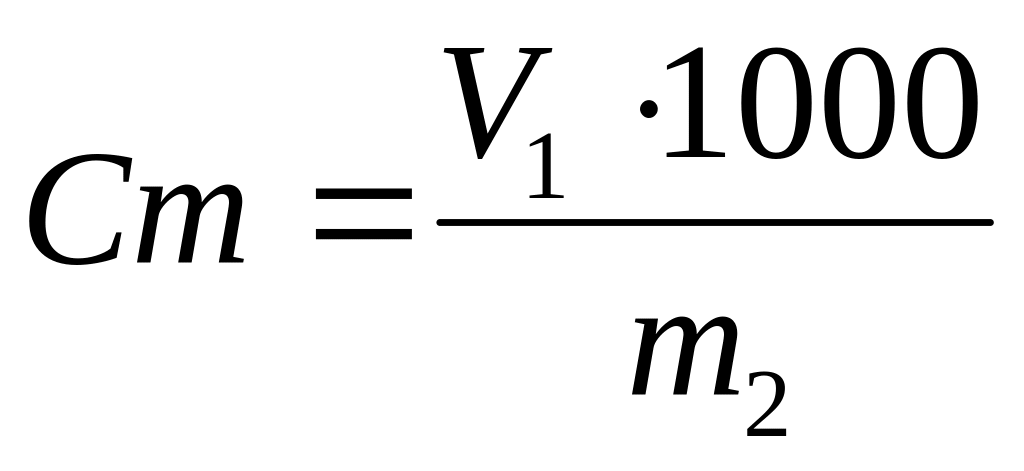
нормальність розчину
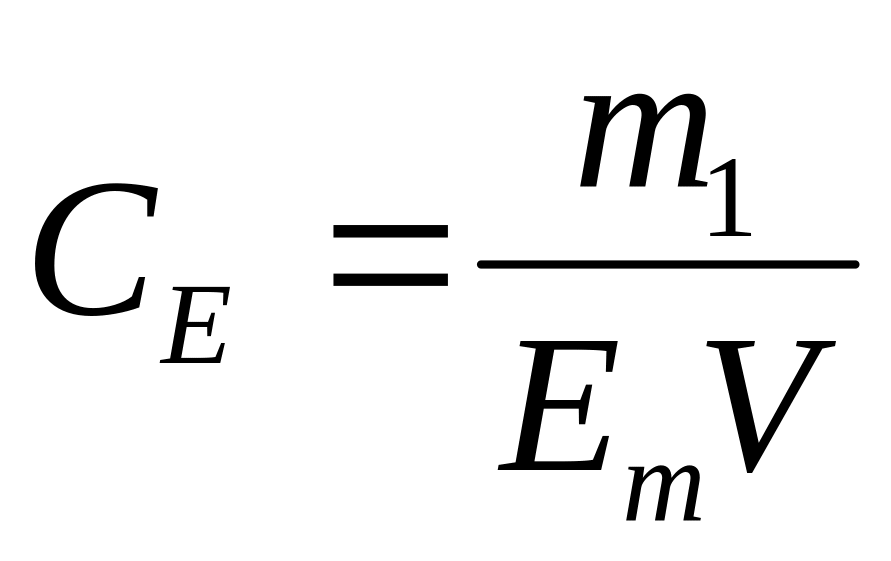
титр ─ відношення маси розчиненої речовини в г до розчину в мл
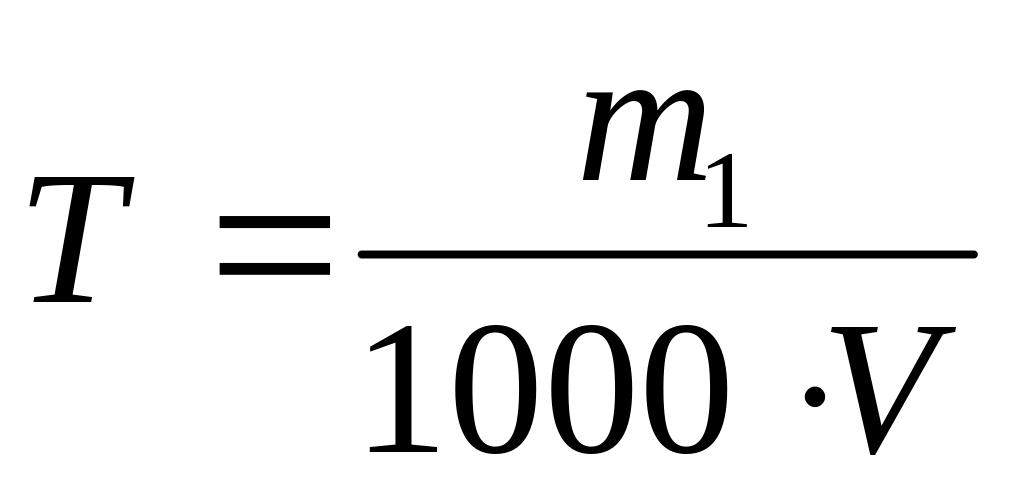
Н.Х.
24.Загальна характеристика та хімічні властивості елементів родини Феруму.
До родини Феруму відносять: Ферум, Кобальт. Нікель. Атоме цих елементів на зовнішньому енергетичному рівні містять по 2 електрона, які вони віддають в хімічних реаціях. Але в утворенні хімічних зв”язків приймають участь також і електрони 3d-орбіталей другого зовні рівня. У своїх стійких сполуках ці елементи проявляють ступінь окиснення +2 і +3. Утворюють оксиди RO i R2O3. Їм відповідають гідроксиди складу R(OH)2 i R(OH)3.
Для родини заліза характерною є властивість приєднувати нейтральні молекули. Залізо є більш реакційноздатним ніж кобальт і нікель. Кобальт і нікель при звичайній температурі стійкі до корозії на повітрі, у воді і різних розчинах. Розведені соляна і сульфатна кислоти легко розчиняють залізо і кобальт, а нікель тільки при нагріванні. Концентрована азотна кислота пасивує всі три метала. При нагріванні ці метали взаємодіють з киснем, парами води, галогенами, сіркою, фосфором, силіцієм, вугіллям і бором. Найбільш стійкими є сполуки заліза (ІІІ), кобальту (ІІ) і нікелю (ІІ).
Метали родини заліза в ряді активностей знаходяться до водню. В природі поширені у вигляді оксидів, сульфідів, сульфатів, карбонатів.
В стані вищіх ступенів окиснення проявляють окисні властивості.
Н.Х.
4.Окисно-відновні реакції та їх класифікація. Напрямок протікання ок.-в. реакцій.
Ок.-в. реакції ─ ре-ції, в результаті проходження яких хімічний зв”язок між окремими атомами реагуючих речовин змінюється з неполярного на полярний (аобо навпаки), змінюється знак полярності на протилежний, змінюється кількість хімічних зв”язків і зарядженість; реакції, які проходять з перерозподілом хімічного зв”язку.
Ступінь окислення─умовний заряд, який мав би атом якби повністю втратив свої валентні електрони, або прийняв їх від відновника.
Нульову ступінь окислення приписують простим речовинам.
Окисники─речовини, які містять в своєму складі атоми або іони, здатні зміщувати до себе частково або повністю приєднувати зв”язуючі електронні пари від інших атомів або іонів і тим самим відновлюватись тобто понижують свою ступінь окислення (O2,O3, H2O2,Hal2, KMnO4K2Cr2O7)
Відновники─ речовини, які містять у своєму складі атоми, або йони, від яких частково зміщуються зв”язки пари, або повністю повністю переходять до інших атомів, які є окисниками і прицьому окислюються тобто збільшують свою ступінь окислення. (активні метали, SnO2, H2, CO,Na2SO3)
Сила, яка регулює процес ок-ня-відн-ня називається окисно-відновним потенціалом., яку можна розрахувати:
![]()
Н.Х.
