
- •Список рекомендуемой литературы
- •Контрольные вопроссы по качественному анализу
- •Тема 1. Основные методы, понятия и метрологические характеристики аналитической химии.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Тема 5. Окислительно - восстановительные реакции в анализе.
- •Тема 6. Комплексные соединения в анализе.
- •Тема 7. Методы разделения и обнаружения.
- •Типовые задачи для самостоятельного решения и примеры решения некоторых типовых задач.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Способы выражения произведения растворимости
- •Тема 5. Окислительно-восстановительные реакции в анализе
- •Тема 6. Комплексные соединения в анализе.
- •Примерный вариант контрольной работы по
Тема 5. Окислительно-восстановительные реакции в анализе
Алексеев В.Н. 305 N° 40, 41; С. 391 N° 1, 4, 5, 10, 14, 15, 16, 17.
Логинов Н.Я. Сб. задач и упр. по кач, анализу.
С. 172 - 176 N° 427, 430, 432, 440, 442, 455, 464.
С. 188 -191 N° 472, 476, 482, 494.
Задачи и вопросы по аналит. хим. (Под ред. Васильева В.П.)
С. 49 N° 250, 260, 265, 270, 277.
Задача 1. Определить, в каком направлениии пойдёт реакция между железом (III) и иодидом калия?
Решение:
Записываем соответствующие полуреакции и находим в таблицах значения стандартных потенциалов:
Fe3+ + e ↔ Fe2+ |2 E˚ Fe3+/ Fe2+ = 0,771B,
I3- +2e ↔ 3I- |1 E˚ I3-/3I- = 0,535B.
Составляем полную окислительно - восстановительную реакцию
2Fe3+ + 3I- ↔ 2Fe2+ + I3-
и находим разность потенциалов
ΔE = E˚ Fe3+/ Fe2+ - E˚ I3-/3I- = 0,771 - 0,535 = +0,236B
Положительная разность потенциалов указываает на протекание реакции в направлении окисления иодид - иона железом (III).
Задача 2. Рассчитать равновесный окислительно-восстановительный потенциал полуреакции
NO2- + 2H+ + e ↔ NO + H2O
при [NO2-] = 0,01M и при pH 1,00.
Решение:
В таблицах находим Е˚ NO2-/ NO = 1,202 В (при рН = 0).
П ользуясь
уравнением Нернста, рассчитываем
равновесный потенциал при условиях
задачи:
ользуясь
уравнением Нернста, рассчитываем
равновесный потенциал при условиях
задачи:
= 1,202 + 0,059 lg 0,01•(10-1)² = 0,966B
Задача 3. Рассчитайте равновесную концентрацию железа (II) в растворе после установления равновесия реакций между 0,01М раствором перманганата калия и 0,05М раствором сульфата железа (П) в 0,18М соляной кислоте.
Решение:
Рассчитываем величину константы равновесия реакции
MnO4- + 5Fe2+ + 8H ↔ Mn2+ + 5Fe3+ + 4H2O
используя табличные значения стандартных потенциалов:
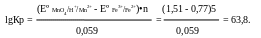
Большое значение Кр ≈ 1•1064 говорит о том, что реакция прошла практически полностью, поэтому можно считать, что [Fe3+] = 0,05М,
[Mn2+] = 0,01M, [H+] = 0,10M. Обозначим [MnO4-] = x; [Fe2+] = 5x

6
x = √ 4,16•10-52 = 2,7•10-9, [Fe2+] = 1,4•10-8 M
Задача 4. Вычислить потенциал водородного электрода в 0,5М растворе ацетата натрия.
Решение:
Равновесный потенциал водородного электрода в заданных условиях вычисляется по уравнению Нернста:

(для полуреакции 2H+ + 2e ↔ H2).
Концентрация ионов водорода в растворе определяется гидролизом ацетат - иона:
CH3COO- + H2O ↔ CH3COOH + OH-

Из ионного произведения воды получаем:

Подставляем найденную величину в уравнение Нернста для расчета равновесного потенциала:
Е 2H+/H2 = 0 + 0,059lg (5,9•10-10) = -0,545 B.
Тема 6. Комплексные соединения в анализе.
В.Н. Алексеев Курс кач. химич. полумикроанализа.
С. 304 N° 31, 26, 27, 33, 35, 36.
Н.Я. Логинов "Сб. задач и упр. по кач. ан."
С. 150 - 160 N° 379, 384, 390, 394, 401, 407.
Задачи и вопросы по аналит. химии (Под ред. Васильева В.П.).
С. 33 - 34, 39 - 44 N°182, 191, 201.
Задача 1. Как диссоциируют комплексные соединения в водном растворе? Написать уравнения, доказывающие диссоциацию K[Ag(CN)2] в водном растворе. Записать выражение констант образования ступенчатых и полной для этого комплекса.
К[Ag(CN)2] → K+ + [Ag(CN)2-]
[Ag(CN)2-] ↔ [Ag(CN)°] + CN- K2 (уст) ←
[Ag(CN)°2] ↔ Ag+ + CN- K1 (уст) ←

[Ag(CN)2-] ↔ Ag+ + 2CN- K общ = K1 •K2
Задача 2. Рассчитайте равновесную концентрацию ионов кадмия в растворе, 1 л которого содержит 0,1М Cd(NO3)2 и 2 моля KI .
Решение:
При данных концентрациях практически весь ион Cd2+ связывается в комплексный ион [CdI4]2-. Равновесие образования этого комплекса
Cd2+ + 4I- ↔ [CdI42-]
Характеризуется константой устойчивости:

При значительном избытке лиганда и достаточно большой величине константы устойчивости можно принять, что
[CdI42-] = C° Cd2+ = 0,1M; [I-] = C°I- - 4C° Cd2+ = 1,6M;
Равновесная концентрации кадмия равна:

Введение KI в раствор Cd(NO3)2 понизило концентрацию ионов кадмия от 0,1 до 1,21•10-8 М.
Задача 3. Вычислить концентрацию ионов Cu2+ , NH3 и степень ионизации комплексного иона в 0,01М растворе аммиаката меди [Cu(NH3)4]Cl2.
Решение:
Аммиакат меди диссоциирует по типу сильных электролитов на катионы комплексного иона и анионы Сl-:
[Cu(NH3)4]Cl- ↔ [Cu(NH3)42+] + 2Cl-
значит, C [Cu(NH3)42+] = 0,01 моль/л; C Cl- = 0,02 моль/л
Комплексный ион [Cu(NH3)42+] диссоциирует частично, по типу слабых электролитов по схеме:
[Cu(NH3)42+] ↔ Cu2+ + 4NH3

Обозначим [Cu2+] = х, тогда [NH3] = 4х, [Cu(NH3)42+] = (0,01 – x)
получим:

Значит, [Cu2+] = 5,16•10-4 M, [NH3] = 2,06•10-3 M, степень ионизации комплексного иона:
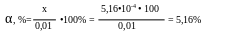
Задача 4. Произойдет ли разрушение комплекса, если к 20 мл 0,02М раствора К3[AlF6] прилить равный объем 0,1М раствора нитрата кальция?
Решение:
После смешивания концентраций обоих веществ уменьшается вдвое: C[AlF6]3- = 0,01M, C Ca(NO3)2 = 0,05M
Соответственно концентрации ионов:
[AlF6]3- = 0,01M [Ca2+] = 0,05M
Константа ионизации комплекса [AlF6]3- равна:

Обозначим количество распавшихся комплексных ионов через х, тогда равновесные концентрации ионов будут равны:
[Al3+] = x, [F-] = 6x, [AlF6]3- = 0,01 - x.
Подставим эти значения в выражения константы ионизации комплекса:

Пренебрегая малым значением х по сравнению с 0,01, решаем уравнение относительно х:
66 • х7 = 2,14•10-23; x = 1,24 •10-4 M
фторид - ионы, образующиеся при ионизации комплекса, могут взаимодействовать с ионами кальция с образованием фторида кальция:
Са2+ + 2F- = CaF2↓
Для определения возможности образования осадка, найдем величину произведения концентраций ионов кальция и фторида и сравним с величиной ПР CaF2 = 4,0•10-11.
[Ca2+][F-]² = 0,05 • (7,44•10-4)² = 2,77•10-8.
Эта величина больше, чем ПР CaF2, поэтому комплексные ионы [AlF6]3- будут разрушаться и выпадет осадок фторида кальция.
