
- •Список рекомендуемой литературы
- •Контрольные вопроссы по качественному анализу
- •Тема 1. Основные методы, понятия и метрологические характеристики аналитической химии.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Тема 5. Окислительно - восстановительные реакции в анализе.
- •Тема 6. Комплексные соединения в анализе.
- •Тема 7. Методы разделения и обнаружения.
- •Типовые задачи для самостоятельного решения и примеры решения некоторых типовых задач.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Способы выражения произведения растворимости
- •Тема 5. Окислительно-восстановительные реакции в анализе
- •Тема 6. Комплексные соединения в анализе.
- •Примерный вариант контрольной работы по
Тема 7. Методы разделения и обнаружения.
Методы обнаружения. Применение реакций образования осадков, окрашенных соединений, выделения газа. Микрокристаллоскопический анализ. Пирохмический анализ: окрашивание пламени, возгонка, образование перлов. Капельный анализ. Люминесцентный, спектральный методы анализа. Экстракция.
Методы разделения. Разделение с использованием реакций осаждения. Групповые реагенты и условия их применения. Кислотно-основная классификация катионов (5 групп). Деление анионов на три группы по растворимости солей бария и серебра. Дробный и систематический ход анализа.
Типовые задачи для самостоятельного решения и примеры решения некоторых типовых задач.
Тема 2. Химическое равновесие.
Н.Я. Логинов, М.Н. Орлова. Сб. задач и упр. по аналит. хим. (кач. ан.). Стр. 49 N° 111, 115, 118, 121, 129.
В.Н. Алексеев. Курс кач. химич. полумикроанализа. Стр. 120 N° 4, 5, 6, 7, 8, 9, 10.
Задачи и вопросы по аналит. хим. (под ред. Васильева В.П.). Стр. 55 N° 1 - 8.
Задача 1. Рассчитайте активность ионов калия и сульфата в 0,10М растворе сульфата калия.
Решение:
1. Рассчитываем ионную силу, создаваемую ионами калия и сульфата
μ = ½ ([К+] • Z²+K+ + [SO42-] • Z2 SO42-) = ½ (0,20 • 1² + 0,10 • 2²) = 0,3.
2. По данной ионной силе рассчитываем коэффициенты активности, пользуясь формулами Дебая - Хюккеля
- lg fi = 0,5 Zi² • √µ, если µ < 0,01,

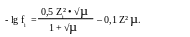
и уравнением Девиса:
если µ = 0,2 - 0,5
(можно пользоваться справочниками по аналитической химии, где приведены зависимости: fK+ = 0,81 и f SO42- = 0,42).
Поэтому в 0,10 М растворе сульфата калия
а K+ = [K+] • f K+ = 0,20 • 0,81 = 0,162;
a SO42- = [SO42-] • f SO42- = 0,10 • 0,42 = 0,042.
Задача 2. Рассчитайте средний коэффициент активности для 0,10М раствора гидроксида натрия и сравните его с экспериментальной величиной 0,764.
Решение:
1. Рассчитываем ионную силу раствора:
µ = ½([Na+] • Z²Na+ + [OH-] • Z²OH-) = ½(0,10 • 1² + 0,10 •1²) = 0,10.
2. По формуле Дебая - Хюккеля находим f±:

f± = 0,757.
Как видно, в данном случае рассчитанное и экспериментально найденное значения среднего коэффициента активности близки, разница составляет 0,8%.
Часто при расчётах сложных равновесий коэффициенты активности принимают равными единице. Такое допущение оправдано: во - первых, величины активности, найденные по формулам Дебая - Хюккеля, могут в этом случае оказаться далёкими от истинных; во - вторых, влияние химических факторов на равновесие гораздо больше, чем электростатических сил.
Задача 3. Термодинамическая константа диссоциации азотистой кислоты равна 6,2•10-4. Рассчитайте реальную (концентрационную) константу диссоциации азотистой кислоты в растворе с ионной силой 0,01.
Решение:
В справочниках находим значение коэффициентов активности ионов Н+ и NO2- при ионной силе, равной 0,01: f Н+ = f NO2- = 0,89. Коэффициент активности молекул азотистой кислоты равен 1.

О тсюда
тсюда
Как видно, электростатические взаимодействия привели к увеличению диссоциации азотистой кислоты.
ОБЩИЙ ПОДХОД К РЕШЕНИЮ РАВНОВЕСИЙ.
Довольно часто необходимо рассчитать:
активность иона по его известной равновесной концентрации и наоборот;
равновесные концентрации ионов или молекул по известной общей (аналитической) концентрации и общую концентрацию вещества по заданной равновесной концентрации.
Для выполнения этих расчётов используют математический аппарат, основанный на уравнении Льюиса, Дебая - Хюккеля, на условии материального баланса и электронейтральности.
Условие материального баланса. Суть условия состоит в неизменности числа атомов данного типа во времени при протекании реакции в изолированной системе.
Например: Напишите уравнение материального баланса для раствора фосфорной кислоты.
В результате диссоциации фосфорной кислоты в растворе находятся ионы Н2РО4-, НРО42-, РО43-, Н+ и молекула Н3РО4. Общая концентрация фосфорной кислоты складывается из суммы равновесных концентраций всех частиц, содержащих атомы Р и O. Поэтому уравнение материального баланса записывается так:
С Н3РО4 = [H3PO4] + [H2PO4-] + [HPO42-] + [PO43-] (по Р)
C Н3РО4 = 3[H3PO4] + 2[H2PO4-] + [HPO42-] + [H+] (по Н+)
Здесь отражена неизменность числа атомов Н в данной системе.
Условие электронейтральности. Условие электронейтральности означает, что общее число положительных зарядов в единице объёма равно числу отрицательных зарядов. В общем, виде уравнение записывается так:
n
i=0
Например: Составьте уравнение электронейтральности для водного раствора нитрата бария.
В водном растворе нитрата бария присутствуют ионы Ва2+, NО3-, Н3О+ и ОН-, образующиеся при диссоциации воды. Следует учесть, что в растворе присутствуют одно- и двух зарядные ионы. Поэтому необходимо удвоить концентрации двухзарядного иона для соблюдения баланса зарядов, поскольку нитрат - ионов образуется в два раза больше, чем ионов бария. Уравнение электронейтральности следует записать так:
2[Ba2+] + [H3O+] = [NO3-] + [OH-].
Задача 4. Рассчитать равновесную концентрацию карбонат - иона в 1,25•10-3 М растворе угольной кислоты при рН 6,00.
Решение:
Составим уравнение материального баланса для раствора угольной кислоты:
С (CO32-) = [H2CO3] + [HCO3-] + [CO32-]
В ыразим
равновесные концентрации гидрокарбонат
иона и угольной кислоты через искомую
концентрацию карбонат - иона, используя
выражения констант диссоциации Н2СО3:
ыразим
равновесные концентрации гидрокарбонат
иона и угольной кислоты через искомую
концентрацию карбонат - иона, используя
выражения констант диссоциации Н2СО3:



[CO32-] = 1,9•10-8 M.
Если в растворе устанавливается более чем одно равновесие, то следует выделить доминирующее равновесие и уравнение материального баланса составить только с учётом этого равновесия. Например, при вычислении рН раствора соляной кислоты устанавливаются два равновесия:
HCl + H2O ↔ H3O+ + Cl-
2H2O ↔ H3O+ + OH-
В не очень разбавленных растворах первое уравнение будет доминирующим, поскольку диссоциацией воды можно пренебречь.
Задания:
Написать уравнения электронейтральности для водных растворов:
а) сульфата калия;
б) хлорида железа (III);
в) гидроксида кальция.
Расчитать равновесную концентрацию гидрокарбонат - иона в 0,1М растворе Na2CO3 при pH = 10,00.
