
- •Список рекомендуемой литературы
- •Контрольные вопроссы по качественному анализу
- •Тема 1. Основные методы, понятия и метрологические характеристики аналитической химии.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Тема 5. Окислительно - восстановительные реакции в анализе.
- •Тема 6. Комплексные соединения в анализе.
- •Тема 7. Методы разделения и обнаружения.
- •Типовые задачи для самостоятельного решения и примеры решения некоторых типовых задач.
- •Тема 2. Химическое равновесие.
- •Тема 3. Кислотно-основное равновесие.
- •Тема 4. Равновесие в системе "осадок - раствор".
- •Способы выражения произведения растворимости
- •Тема 5. Окислительно-восстановительные реакции в анализе
- •Тема 6. Комплексные соединения в анализе.
- •Примерный вариант контрольной работы по
Тема 3. Кислотно-основное равновесие.
Логинов Н.Я., М.Н. Орлова Сб. задач и упр. по кач. ан. С. 64 - 65 N° 157, 158, 159, 164, 170, 173, 180. С. 72 - 74 N° 188, 193, 200.
Алексеев В.Н. С. 120 N° 13, 14, 15, 20, 22, 23.
Задачи и вопросы по аналит. химии (под ред. Васильева В.П.) С. 10 N° 1, 18, 29, 36, 38, 46, 53, 63. С. 16 -21 N° 1, 4, 6, 7, N° 83, 85, 92, 86, 106, 94.
Задача 1. Вывести формулу и рассчитать рН 0,01М раствора соляной кислоты.
Решение:
В растворе соляной кислоты диссоциация идёт нацело:
HCl → H+ + Cl-,
Поэтому, а H+ ≈ [H+] = CHCl = 0,01M.
рН = 2,0
Задача 2. Вывести формулу и рассчитать рН 0,01М раствора гидроксида калия. Аналогично, в растворе сильного основания
а OH- ≈ [OH-] = CKOH,

рН = 12,0.
Подобные расчёты можно проводить лишь в том случае, если в растворе нет других источников протонов или ими можно пренебречь. Так, протонами, образующимися при диссоциации воды, можно пренебречь, если С HA(MOH) ≥ 1•10-4 М, при меньшей концентрации кислоты (основания) диссоциацию воды надо учитывать.
Задача 3. Рассчитать рН 1,0•10-8 М раствора соляной кислоты.
Решение:
Запишем уравнение электронейтральности:
[H+] = [Cl-] + [OH-]
Так как соляная кислота сильная, [Cl-] = CHCl,
Отсюда: KH2O = [H+] [OH-] = [H+] ([H+] - CHCl).
Отсюда: [H+]² – CHCl [H+] – KH2O = 0
[H+]² - 1,0•10-8 [H+] - 1,0• 10-14 = 0

pH = 6,98
Без учёта диссоциации воды получили бы неправильное значение 8,00.
Задача 4. Рассчитать рН 0,10М раствора уксусной кислоты.
Если степень диссоциации кислоты мала (h < 5%), то можно полагать, что равновесная концентрация недиссоциированной кислоты равна общей концентрации кислоты. В данной задаче

Решение:
В растворе уксусной кислоты устанавливается равновесие
CH3COOH ↔ CH3COO- + H+

Отсюда, [H+] = √K CH3COOH • C CH3COOH
[H+] = √1,75•10-5 • 1,0•10-1 = 1,32•10-3 M;
pH = -lg[H+] = 2,88.
Если h > 5%, необходимо учесть, что [HA] ≠ CHA, и поэтому

Задача 5. Рассчитать рН 0,10М раствора фосфорной кислоты.
Решение:
Поскольку константы диссоциации фосфорной кислоты по стадиям значительно различаются:
К = 7,08•10-3 К = 6,17•10-8 К = 4,68•10-13
то можно пренебречь диссоциацией фосфорной кислоты по второй и третьей стадии.
Оценим степень диссоциации фосфорной кислоты при концентрации 0,10М:

Следовательно, H3PO4 ≠ С H3PO4 , расчёт ведём по более точной формуле:


pH = 1,63.
Задача 6. Рассчитать рН 0,10М раствора аммиака.
Решение:
В растворе аммиака устанавливается равновесие:
NH3 + H2O ↔ NH4+ + OH-
Степень диссоциации в 1,0•10-1 М водном растворе < 5%. Следовательно,

pH = 11,12.
Задача 7. Рассчитать рН 0,10М раствора ацетата натрия.
Решение:
В растворе ацетата устанавливается равновесие:
СH3СOO- + H2O ↔ CH3COOH + OH-
П о
справочнику находим КCH3COOH
= 1,75•10-5 и рассчитываем К сопряжённого
основания СН3СОО-:
о
справочнику находим КCH3COOH
= 1,75•10-5 и рассчитываем К сопряжённого
основания СН3СОО-:
Малое значение константы диссоциации указывает на то, что ацетатион - очень слабое основание. Расчёт [H+] проводится по той же формуле, что приведена для слабых оснований:

рН = 8,88.
Задача 8. Рассчитать рН 0,10М раствора цианида аммония.
Решение:
В растворе цианида аммония содержится донор протонов - ион аммония и акцептор протонов - цианид - ион:
NH4+ + CN- + H2O ↔ NH3•H2O + HCN;
Следовательно, цианид аммония является амфолитом.

Из уравнений ионизации констант раствора аммиака и синильной кислоты находим концентрации продуктов протолиза:


Подставляем найденные выражения в уравнение К протолиза:

Сделаем подстановку:
[HCN] ≈ [NH3] и [CN-] = [NH4+] = C NH4CN
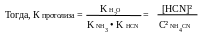

значение [HCN] в уравнение для К протолиза и, решая его относительно [H+], получим


В справочнике находим значение констант аммиака и синильной кислоты:
K NH3 = 1,76•10-5; K HCN = 6,20•10-10 и подставляем их в формулу для расчёта [H+]:

рН = 9,22
Расчёт этот даёт приблизительные значения, так как К кислоты и основания значительно различаются.
Задача 9. Рассчитайте, как изменится рН, если к 1,0 л буферного раствора, состоящего из 0,010М уксусной кислоты и 0,010М ацетата натрия, прибавить 1,0•10-2 моля соляной кислоты.
Решение:
Рассчитываем рН буферного раствора до добавления соляной кислоты:

рН = 4,75
При добавлении соляной кислоты концентрация кислоты увеличивается на добавленную величину, а концентрация сопряжённого основания (соли) - уменьшается:
C CH3COOH = 0,010 + 0,001 = 0,011M
C CH3COOH = 0,010 - 0,001 = 0,009M
Рассчитываем концентрацию [H+] при образовавшихся концентрациях кислоты и соли:

pH = 4,67
Таким образом, рН буферного раствора изменился незначительно.
Задача 10. В каких молярных соотношениях следует взять растворы солей дигидрофосфата и гидрофосфата калия, чтобы получить буферный раствор с рН = 6,00?
Решение:
По величине рН находим [H+]:
pH = -lg[H+] = 6,0; lg[H+] = -6,0
[H+] = 1,0•10-6 M
В данной буферной смеси дигидрофосфат - ионы - кислота, гидрофосфат - ионы - сопряжённое основание. Поэтому для расчёта [H+] используем вторую константу фосфорной кислоты. K2 H3PO4 = 6,2•10-8.


Следовательно, при соотношении концентрации дигидрофосфата и гидрофосфата калия, равном 16,1:1, рН буферного раствора будет равен 6,0.
