
- •Питання самостійної роботи
- •Практичні завдання
- •Література
- •Тема 2. Метали і сплави в сучасній техниці.
- •2.1. Термінологічний словник
- •2.2. Питання самостійної роботи
- •2.3. Практичні завдання
- •Література
- •Тема 3. Природні джерела вуглеводнів. Нафта газ та їх застосування. Охорона довкілля
- •Термінологічний словник
- •Питання самостійної роботи
- •Література
- •Тема 4. Нітрогеновмісні сполуки: аміни, амінокислоти, білки
- •Термінологічний словник
- •Амінокислоти
- •Синтетичне волокно.
- •Питання самостійної роботи
- •Практичні завдання
- •Література
- •Тема 5. Синтез органічних сполук різних класів
- •5.1. Термінологічний словник
- •Питання самостійної роботи. Практичні завдання
- •Література
- •Тема 6. Вивчення властивостей полімерів
- •Термінологічний словник
- •Загальна характеристика та класифікація
- •Фізичні властивості
- •Структура полімерів
- •Хімічна будова
- •Молекулярна маса
- •Застосування
- •Сировинна база виробництва полімерів
- •Література
- •Тема 7. Хімія та їжа: жири, білки, вуглеводи, вітаміни. Харчові додатки
- •Термінологічний словник
- •Парафінові яблука та желатинові цукати
- •Маслини — фарбовані оливки
- •М'яса у котлетах не знайдено
- •Майонез із довічним терміном придатності
- •Трансгенні солодощі
- •Практичні завдання
- •Тема 8. Хімія та побу: побутові хімікати, мило, смз, розчинники
- •8.1. Термінологічний словник.
- •Значення хімії у створенні нових матеріалів
- •Значення хімії у розв'язанні сировинної проблеми
- •8.2. Питання самостійної роботи
- •Тема 9. Хімія та здоров’я. Лікарськи препарати
- •9.1. Термінологічний словник.
- •9.2. Питання самостійної роботи
Амінокислоти
Склад і будова молекул. Молекули амінокислот містять дві функціональні групи: карбоксильну та аміногрупу. Існують амінокислоти, що містять дві карбоксильні або дві аміногрупи, гідроксильні групи, сульфуровмісні групи. Приклади амінокислот (табл. 3.7.16.):

Фізичні властивості. Амінокислоти – кристалічні речовини, мають високі температури плавлення, розчиняються у воді. Цим властивостям відповідає структура біполярного йона:

Хімічні властивості.
Реакції амінокислот

|
Найважливіша особливість амінокислот – здатність молекул взаємодіяти між собою з утворенням поліпептидів:

Зв'язок між залишками
амінокислот називають пептидним,
а
|
Поліпептидний ланцюг є основою будови молекул білків.
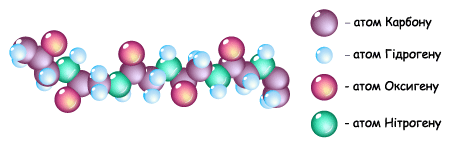
Рис. 3.7.36. Фрагмент моделі поліпептидного ланцюга
Застосування.

Білки
Будова білків. Кожен білок має набір амінокислот, сполучених у певній, властивій тільки йому послідовності. Кількість сполучених у різній послідовності амінокислотних залишків сягає 1018.
Будова білків дуже
складна і зумовлюється не лише
послідовністю амінокислотних залишків.
Довгі ланцюги білкових молекул скручуються
у спіралі, спіралі – у клубки, що певним
чином розміщуються у просторі. Розрізняють
первинну, вторинну, третинну й
|

Рис. 3.7.37. Структура білка:
а,б,в – відповідно первинна, вторинна, третинна структури міоглобіну
(цифри – число амінокислотних залишків у молекулі);
г –
Властивості
білків. Білки
дуже різняться між собою за властивостями,
оскільки містять залишки амінокислот
з різними
функціональними
1. Денатурація.
У результаті нагрівання білка відбувається
його денатурація
(втрата
природних якостей). При цьому руйнується
складна структура білка, що призводить
до втрати ним біологічної активності.
Це необоротний
2. Гідроліз.
Під дією
кислот, лугів, ферментів відбувається
розщеплення полімерної білкової молекули
на амінокислоти. Молекули води приєднуються
за місцем пептидних
зв'язків,
останні руйнуються, замість пептидних

3. Розкладання.
Під дією мікроорганізмів білки
розкладаються з утворенням амоніаку,
сірководню, фенолу, інших речовин з
неприємним запахом. Його поява засвідчує,
що відбувається
4. Кольорові реакції. Для аналітичного виявлення використовують кольорові реакції білків. Поява жовтого забарвлення в результаті реакції з концентрованою нітратною кислотою засвідчує наявність бензенових ядер у структурі білка. Червоно-фіолетове забарвлення білка в результаті дії купрум(ІІ) гідроксиду засвідчує наявність пептидних зв'язків.
Біологічне значення амінокислот і білків. Білки є основним будівельним матеріалом тваринних організмів, а сааме їх клітин. Білки їжі безпосередньо не засвоюються організмом, спершу вони гідролізують до амінокислот, останні всмоктуються у кров, нею переносяться до печінки, де організм синтезує білки.

