
- •Питання самостійної роботи
- •Практичні завдання
- •Література
- •Тема 2. Метали і сплави в сучасній техниці.
- •2.1. Термінологічний словник
- •2.2. Питання самостійної роботи
- •2.3. Практичні завдання
- •Література
- •Тема 3. Природні джерела вуглеводнів. Нафта газ та їх застосування. Охорона довкілля
- •Термінологічний словник
- •Питання самостійної роботи
- •Література
- •Тема 4. Нітрогеновмісні сполуки: аміни, амінокислоти, білки
- •Термінологічний словник
- •Амінокислоти
- •Синтетичне волокно.
- •Питання самостійної роботи
- •Практичні завдання
- •Література
- •Тема 5. Синтез органічних сполук різних класів
- •5.1. Термінологічний словник
- •Питання самостійної роботи. Практичні завдання
- •Література
- •Тема 6. Вивчення властивостей полімерів
- •Термінологічний словник
- •Загальна характеристика та класифікація
- •Фізичні властивості
- •Структура полімерів
- •Хімічна будова
- •Молекулярна маса
- •Застосування
- •Сировинна база виробництва полімерів
- •Література
- •Тема 7. Хімія та їжа: жири, білки, вуглеводи, вітаміни. Харчові додатки
- •Термінологічний словник
- •Парафінові яблука та желатинові цукати
- •Маслини — фарбовані оливки
- •М'яса у котлетах не знайдено
- •Майонез із довічним терміном придатності
- •Трансгенні солодощі
- •Практичні завдання
- •Тема 8. Хімія та побу: побутові хімікати, мило, смз, розчинники
- •8.1. Термінологічний словник.
- •Значення хімії у створенні нових матеріалів
- •Значення хімії у розв'язанні сировинної проблеми
- •8.2. Питання самостійної роботи
- •Тема 9. Хімія та здоров’я. Лікарськи препарати
- •9.1. Термінологічний словник.
- •9.2. Питання самостійної роботи
САМОСТІЙНА РОБОТА
з дисципліни: «ХІМІЯ»
Міністерство освіти та науки України
Державний вищій навчальний заклад
«Краснодонський промислово-економічний коледж»
САМОСТІЙНА РОБОТА
з дисципліни: «ХІМІЯ»
Для спеціальностей:
5.03050401 «Економіка підприємства»
5.03050702 «Бухгалтерський облік»
5.03050901 «Комерційна діяльність»
5.05010201 «Обслуговування комп’ютерних систем і мереж»
5.05070103 «Електропостачання»
5.05030102 «Підземна розробка корисних копалин»
5.05030104 «Експлуатація і ремонт гірничого обладнання та пристроїв»
Викладач: Зелінська С. О.
розглянуто та ухвалено на засіданні
циклової комісії гуманітарних та
фундаментальних дисциплін
протокол № _____ від ___________
голова комісії Матвєєва Т. О.
Краснодон 2011
ЗМІСТ
ТЕМА 1. ХІМІЧНІ ВЛАСТИВОСТІ СУЛЬФАТНОЇ КИСЛОТИ.
Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
Тема 2. МЕТАЛИ І СПЛАВИ В СУЧАСНІЙ ТЕХНИЦІ. ОХОРОНА ДОВКІЛЛЯ.
2.1. Термінологічний словник.
2.2. Питання самостійної роботи
2.3. Практичні завдання
Література
ТЕМА 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ. НАФТА ГАЗ ТА ЇХ ЗАСТОСУВАННЯ. ОХОРОНА ДОВКІЛЛЯ
Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
ТЕМА 4. НІТРОГЕНОВМІСНІ СПОЛУКИ: АМІНИ, АМІНОКИСЛОТИ, БІЛКИ
Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
ТЕМА 5. СИНТЕЗ ОРГАНІЧНИХ СПОЛУК РІЗНИХ КЛАСІВ
Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
ТЕМА 6. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ ПОЛІМЕРІВ
Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
ТЕМА 7. ХІМІЯ ТА ЇЖА: ЖИРИ, БІЛКИ, ВУГЛЕВОДИ, ВІТАМІНИ. ХАРЧОВІ ДОДАТКИ
7.1. Термінологічний словник
Питання самостійної роботи
Практичні завдання
Література
ТЕМА 8. ХІМІЯ ТА ЗДОРОВ’Я. ЛІКАРСЬКИ ПРЕПАРАТИ
8.1. Термінологічний словник.
8.2. Питання самостійної роботи
8.3. Практичні завдання
8.4. Література
ТЕМА 9. ХІМІЯ ТА ПОБУ: ПОБУТОВІ ХІМІКАТИ, МИЛО, СМЗ, РОЗЧИННИКИ
9.1. Термінологічний словник.
9.2. Питання самостійної роботи
9.3. Практичні завдання
Література
ТЕМА 10. ПОРІВНЯННЯ ВЛАСТИВОСТЕЙ МИЛА І СМЗ. ВИДАЛЕННЯ ЗАБРУДНЕНЬ ІЗ ПОВЕРХНІ ІЗ ПОВЕРХНІ ТКАНИНИ
10.1. Термінологічний словник.
10.2. Питання самостійної роботи
10.3. Практичні завдання
Література
ТЕМА 11. ЗНАЧЕННЯ ХІМІЇ ЯК НАУКИ І ЇЇ РОЛЬ У ВИРІШЕННІ ГЛОБАЛЬНИХ ПРОБЛЕМ ЛЮДСТВА
11.1. Термінологічний словник.
11.2. Питання самостійної роботи
11.3. Практичні завдання
Література
ТЕМА 1. ХІМІЧНІ ВЛАСТИВОСТІ СУЛЬФАТНОЇ КИСЛОТИ.
1.1.Термінологічний словник
Ви вже знаєте, що дуже реакційно-здатний газ. Він взаємодіє з багатьма металами, неметалами і багатьма складними речовинами, виявляючи властивості сильного окислювача.
Які речовини утворяться при взаємодії з киснем: а) водню; б) алюмінію; в) метану СН4? Напишіть рівняння реакцій, вкажіть у кожнім випадку ступінь окислювання елементів, окислювач і востановитель.
Хімічна активність сірки також досить висока. При нагріванні вона взаємодіє майже з усіма хімічними елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окислювача, так і восстановителя (порівняєте з киснем), тому що для неї характерні як позитивні ступені окислювання (+4, +6), так і негативна (-2).
Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (крім золота), утворити сульфіди. Так, якщо всипати порошок міді в розплавлену сірку (мал. 3), те відбудеться реакція з утворенням чорного сульфіду міді(1) і виділенням великої кількості теплоти:
2Cu + S = Cu2S

• Сірка безпосередньо з'єднується з залізом, цинком, натрієм, алюмінієм. Напишіть рівняння цих реакцій і вкажіть назви речовин, що утворилися.
Взаємодія з неметалами. Сірка безпосередньо взаємодіє з усіма неметалами (крім йоду й азоту). Реакції відбуваються при нагріванні
S + О2 = SO2 ↑
Н2 + S = H2S ↑
Застосування. Більше всього сірі і природні сульфіди витрачається на виробництво сірчаної кислоти. Сірка застосовується й в інших галузях хімічної промисловості: для одержання сульфітів Na2SO3 і Ca(HSO3)2 для легкої промисловості, сульфідів Na2S, Ca, Ba для шкіряного виробництва, виготовлення люмінофорів (речовин, здатних світитися). Сірку застосовують у виробництві барвників, гуми, чорного пороху, сірників, лік; використовують її м у сільському господарстві для боротьби зі шкідниками.
Питання самостійної роботи
1. Які хімічні властивості характерні для кисню і сірки? Напишіть рівняння відповідних реакцій.
2. Порівняєте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?
3. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль грає сірка в одній і інший реакціях?
4. Якого типу хімічний зв'язок у з'єднання! сірки з металами"?
5. Чому кисень виявляє окисні властивості, а сірка як: окисні, так і відбудовні?
6. Напишіть кілька рівнянь реакцій, що свідчать про те, що в кисню окисні властивості виявляються сильніше, ніж у сірки.
7. Якщо 31 м залоза взаємодіє із сіркою за умови, що масова частка використання заліза складає 9ПРО %, те в результаті реакції утвориться сульфід заліза масою
(а) 12 м; (в) 44 м;
(б) 22 м; (г) 88 р.
Практичні завдання
Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів кисню і полонію різко відрізняються друг від друга по властивостях. Як ви думаєте, чим це можна пояснити?
Література
Тема 2. Метали і сплави в сучасній техниці.
ОХОРОНА ДОВКІЛЛЯ.
2.1. Термінологічний словник
Сплави металів
Більшість металів при їх сумісному плавленні змішуються один з одним і, кристалізуючись, утворюють сплави та/чи інтерметалічні сполуки. Всі сплави, як і метали, в твердому стані кристалічні. Сплави поділяють на однорідні і неоднорідні. Більшість сплавів належить до неоднорідних.
Однорідні сплави утворюються в тих випадках, коли атоми одного металу можуть заміщатися атомами другого металу у вузлі кристалічної ґратки. При такому заміщенні утворюються кристали із структурою схожою на структуру вихідних металів, проте із атомами різного сорту, чим і обумовлюється однорідність сплаву. Такі сплави називають твердими розчинами. Тверді розчини утворюють золото із сріблом, нікель з міддю і ін.
Неоднорідні сплави являють собою механічну суміш кристаликів обох металів. При цьому кожний із металів зберігає свою кристалічну ґратку. Наприклад, сплав олова зі свинцем (припій) складається з кристаликів чистого олова і кристаликів чистого свинцю.
Сплави можуть утворюватись не тільки двома, а й кількома металами. Сплави з двох металів називають подвійними, з трьох — потрійними і т. д. Крім того, до складу сплавів можуть входити і неметали, як вуглець, фосфор, сірка тощо. Деякі метали при сплавленні утворюють хімічні сполуки. При цьому одні хімічні сполуки підлягають правилам звичайної валентності, як Mn2Sn, Mg2Pb і ін., а деякі не підлягають, наприклад CuZn3, Cu3Sn, Fe3C тощо. Хімічні сполуки металів характеризуються власною кристалічною ґраткою, відмінною від кристалічних ґраток металів, які входять до її складу. При надлишку одного з металів хімічні сполуки можуть утворювати як тверді розчини, так і механічні суміші.
За своїми властивостями сплави різко відрізняються від чистих металів, з яких вони складаються. Температура плавлення сплавів звичайно нижча від температури плавлення металів, що входять до їхнього складу. Так, натрій і калій при певному складі утворюють сплав, який при звичайній температурі є рідиною, хоча натрій плавиться при 97,5°С, а калій — при 62,3°С.
Твердість сплавів у більшості випадків вища від твердості окремих металів, що їх утворюють. Наприклад, добавка 1% берилію до міді збільшує її твердість у 7 разів. Ковкість і пластичність металів у сплавах звичайно знижується. Тепло- і електропровідність металів у сплавах теж зменшується. Механічна міцність сплавів, навпаки, у більшості випадків підвищується. Навіть незначні домішки іншого металу часто різко підвищують міцність сплаву. Хімічні властивості металів у сплавах теж змінюються. Наприклад, при додаванні до звичайної сталі 15—20% силіцію одержують кислотостійку сталь.
Металічні сплави мають надзвичайно велике значення, оскільки в техніці застосовують звичайно не чисті метали, а сплави. Сучасна техніка вимагає сплави з найрізноманітнішими властивостями: надтверді і м'які, тугоплавкі і легкоплавкі, стійкі до дії різних газів, кислот, лугів і т. д. Тепер відомо вже кілька тисяч різних сплавів з різноманітними властивостями. Серед них найбільш поширені сплави на основі заліза і алюмінію.
Метали - клас хімічних елементів з певними хімічними і фізичними властивостями: метали добре проводять електрику і тепло, непрозорі, але можуть відбивати світло; ковкі, що дозволяє надавати виробам з них потрібну форму і розкатувати в плоскі пластинки, пластичні, що дає можливість витягати тонкий дріт.
Металами є прості речовини більшості хімічних елементів (приблизно 80 %). Найпоширенішим хімічним елементом-металом, у земній корі є алюміній.
Широко використовуються такі типи металів:
чорні метали — залізо, манган, хром.
дорогоцінні метали: золото, срібло і платина, використовуються переважно в ювелірній промисловості;
важкі метали: мідь, цинк, олово і свинець, застосовуються в машинобудуванні;
рідкісні важкі метали: нікель, кадмій, вольфрам, молібден, манган, кобальт, ванадій, вісмут, використовуються в сплавах з важкими металами;
легкі метали: алюміній, титан і магній;
лужні метали: калій, натрій і літій
лужноземельні метали: кальцій, барій і стронцій, застосовуються в хімії
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату). Піну з сульфідами металів зливають з чану і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.
Схема флотаційного апарату
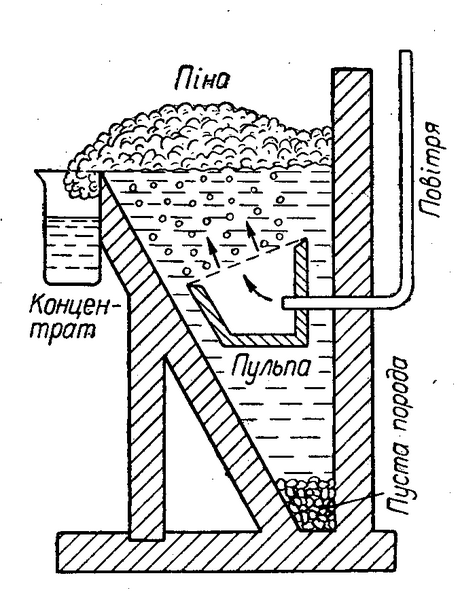
Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх при високих температурах. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
Fe2O3 + 3C = 2Fe + 3CO ↑
Fe2O3 + 3CO = 2Fe + 3CO2 ↑
SnO2 + C = Sn + CO2 ↑
2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану і ін. як відновник застосовують алюміній (алюмінотермія):
Cr2O3 + 2Al = 2Cr + Al2O3
3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
2PbS + 3O2 = 2PbO + 2SO2 ↑
PbO + C = Pb + CO ↑
Найактивніші метали — калій, натрій, кальцій і ін. — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:
