
- •Глава 8. Физико-химические методы очистки сточных вод
- •8.1. Коагуляция и флокуляция
- •8.2. Флотация
- •8.3. Адсорбция
- •8.4. Ионный обмен
- •8.5. Экстракция
- •8.6. Обратный осмос и ультрафильтрация
- •8.7. Десорбция, дезодорация и дегазация
- •8.8. Электрохимические методы
- •Глава 9. Химические методы очистки сточных вод
- •9.1. Нейтрализация
- •9.2.Окисление и восстановление
- •9.3. Удаление ионов тяжелых металлов
- •Глава 10. Биохимические методы очистки сточных вод
- •10.1. Общие положения
- •10.2. Закономерности распада органических веществ
- •10.3. Влияние различных факторов на скорость биохимического окисления
- •10.4. Очистка в природных условиях
- •10.5. Очистка в искусственных сооружениях
- •10.6. Анаэробные методы биохимической очистки
- •10.7. Обработка осадков
- •10.8. Рекуперация активного ила
- •Глава 11. Термические методы очистки сточных вод
- •11.1. Концентрирование сточных вод
- •11.2. Выделение веществ из концентрированных растворов
- •11.3. Термоокислительные методы обезвреживания
9.2.Окисление и восстановление
Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Очистка окислителями связана с большим расходом реагентов, поэтому ее применяют только в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно или нельзя извлечь другими-способами. Например, очистка от цианидов, растворенных соединений мышьяка и др.
Активность вещества как окислителя определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона — 2,07; для хлора — 0,94; для пероксида водорода — 0,68; для перманганата калия — 0,59.
Окисление хлором. Хлор и вещества, содержащие "активный" хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др. При введении хлора в воду образуются хлорноватистая [оксохлорат (I) водорода] и соляная (хлороводородная) кислоты:
С12+Н2О = НОС1 + НС1. (II.141)
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН = 4 молекулярный хлор практически отсутствует:
![]()
Сумма Cl2 + Н0С1 + 0С1- называется свободным "активным" хлором.
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2C1 и дихлорамин NHC12 . Хлор в виде хлорамина называется связанным "активным" хлором.
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. II-59. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
![]()
Источниками "активного" хлора могут быть также хлорат кальция, гипохлориты, хлораты, диоксид хлора. Хлорат кальция (хлорную известь) получают при взаимодействии:
Са(ОН)2 +С12 = СаОС12 + Н2О. (II. 143)
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
С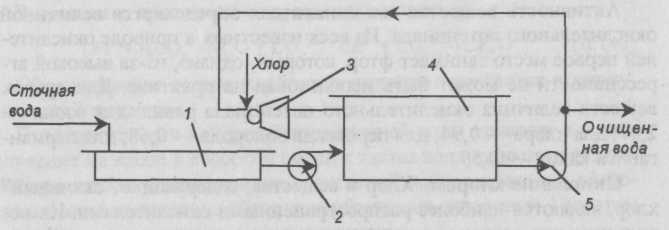 12
+ 2NaOH = NaCIO + NaCl. (II. 144)
12
+ 2NaOH = NaCIO + NaCl. (II. 144)
Рис. II-59. Схема установки для очистки воды хлорированием: 1— усреднитель; 2, 5 — насосы; 3 — инжектор; 4 — емкость
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25-30°С:
Са(ОН)2 + 2С12 = Са(СlO)2 + СаС12 + 2Н2О. (II.145)
Промышленность выпускает двухосновную соль Са(С1О2) 2Са(ОН)22Н2О.
Сильным окислителем является хлорат натрия NaC1О2, который разлагается с выделением С1О2. Диоксид хлора — зеленовато-желтый ядовитый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
2NaC1О2 + С12→2С1О2 + 2NaCl,
5NaC1О2 + 4HCl→5NaCl + 4С1О2 + 2Н2О. (II. 146)
При окислении цианидов "активным" хлором процесс можно проводить в одну ступень до получения цианатов:
CN- + ОСl-→CNO- + Сl-. (II.147)
Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образовавшиеся цианаты легко гидролизуются до карбонатов:
CNO- + 2H2O→CO32- + NH4+. (II. 147a)
Скорость гидролиза зависит от рН среды. При рН=5,3 за сутки гидролизуется около 80% цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по реакции (II.147). На второй ступени вводят дополнительное количество окислителя и реакция протекает по уравнению.
2CNO- + 3OС1- + Н2O→2СО2 + N2 + 2ОН- + ЗС1-. (II.1476)
Во время реакций рН поддерживают в пределах 8-11. Контроль полноты окисления производят по остаточному "активному" хлору, концентрация которого должна быть не менее 5-10 мг/л.
Товарный хлорат кальция содержит до 33% "активного" хлора, а гипохлорит кальция — до 60%. Потребность реагентов х1 (в кг/сут) для окисления подсчитывается по формуле:
x1 = xClQn/a, (II.148)
где хCl — расход "активного" хлора, необходимого для окисления цианидов, кг/м3; Q — расход воды, м3/сут; n — коэффициент избытка реагента (n =1,2-1,3); а — содержание "активного" хлора в реагенте, в долях единицы.
Окисление пероксидом водорода. Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85-95%-ный пероксид водорода и пергидроль, содержащий 30% Н2О2. Пероксид водорода токсичен. ПДК в воде составляет 0,1 мг/л.
Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
2Н+ + Н2О2 + 2е→2Н2О, 2ОН- + Н2О2 + 2е→2Н2О + 2О2 -. (II. 149)
В кислой среде более отчетливо выражена окислительная функция, а в щелочной — восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту — в азотную, сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелочной среде (рН = 9-12).
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы — ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Co2+, Cr2+, Ag+). Например, процесс окисления пероксидом водорода с солью железа протекает весьма эффективно при рН = 3-4,5. Продуктами окисления являются муконовая и малеиновая кислоты.
В процессах водообработки используют не только окислительные, но и восстановительные свойства пероксида водорода. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоритами, переводя их в хлориды:
Н2О2 + С12→О2 + 2НС1, NaC1O + Н2О2→ NaC1 + O2 + Н2O (II. 150)
Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
МnО2 + Н2О2 + 2НС1→МnС12 + 2Н2О + О2. (II. 151)
Перспективным является окисление загрязнений пероксосерны-ми кислотами: пероксомоносерной H2SO5 и пероксодисерной H2S2O8. Например, фенол окисляется пероксомоносерной кислотой (кислота Каро) при рН =10. Этим методом возможно снизить содержание фенола до 5 * 10-6 %. Скорость окисления зависит от соотношения H2SO5/C6H5OH и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот протекает также очень быстро. При этом в случае небольших концентраций цианидов (0,01-0,05%) в сточной воде используют H2SO5 , a при высоких концентрациях — H2S2O8. Оптимальным условиям соответствует рН = 9. В нейтральной среде реакция окисления резко замедляется под действием ионов железа, которые образуют ферроцианы, не подвергающиеся окислению.
Окисление кислородом воздуха. Кислород воздуха используют при очистке воды от железа для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме:
4Fe2++ О2 + 2Н2О = 4Fe3++ 4OH- ; Fe3++ 3H2O = Fe(OH)3+ 3H+. (II.152)
Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой насадкой. Образующийся гидроксид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой насадкой или кольцами Рашига нецелесообразно, так как происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае над поверхностью фильтра разбрызгивают воду, которая в виде капель падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с -2 до +6:
S2 - → S → SnO62 - → S2O32 - → SO32 - → SO42 -. (II. 152а)
При этом при окислении гидросульфида и сульфида до тиосульфата рН раствора повышается, при окислении гидросульфида до сульфида и сульфата рН раствора понижается, а при окислении сульфида до сульфита и сульфата активная реакция среды не изменяется.
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1г сульфидной серы расходуется 1г кислорода. Принципиальная схема установки окисления сульфидов приведена на рис. II-60.
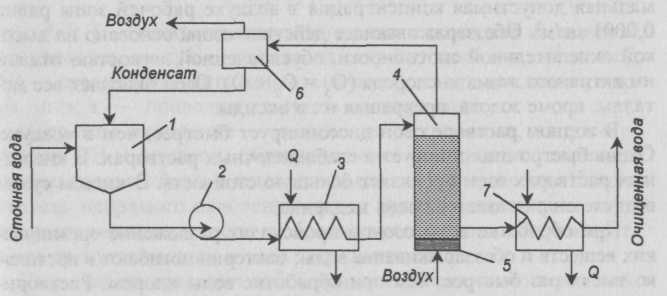
Рис. II-60. Схема установки окисления сульфидов: 1 — приемный резервуар; 2 — насос; 3 — теплообменник; 4 — окислительная колонна; 5 — воздухораспределительное устройство; 6 — сепаратор; 7 — холодильник
Окисление пиролюзитом. Процесс проводят фильтрацией сточной воды через этот материал или в аппаратах с мешалкой. Пиролюзит является природным материалом, состоящим в основном из диоксида марганца. Его широко используют для окисления трехвалентного мышьяка в пятивалентный:
H3As О3 + MnO2 + H2SO4 = H3As О4 + MnSO4 + Н2О. (II. 153)
Повышение температуры способствует увеличению степени окисления. Оптимальный режим окисления следующий: расход МnО2 — четырехкратный по сравнению со стехиометрическим, кислотность воды 30-40 г/л, температура воды 70-80°С.
Озонирование. Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др.
Озон — газ бледно-фиолетового цвета. В природе находится в верхних слоях атмосферы. При температуре — 111,9°С озон превращается в нестойкую жидкость темно-синего цвета. Физико-химические свойства озона: относительная молекулярная масса 48; плотность (при температуре 0°С и давлении 0,1 МПа) 2,154 г/л; температура плавления 192,5°С; теплота образования 143.64 кДж/моль; коэффициент растворимости в воде при 0°С — 0,49, при 20°С — 0,29; окислительно-восстановительный потенциал 2,07 В.
Чистый озон взрывоопасен, так как при его разложении высвобождается значительное количество тепла; очень токсичен. Максимальная допустимая концентрация в воздухе рабочей зоны равна 0,0001 мг/м3. Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3 = О2 + О). Озон окисляет все металлы, кроме золота, превращая их в оксиды.
В водном растворе озон диссоциирует быстрее, чем в воздухе. Очень быстро диссоциирует в слабощелочных растворах. В кислотных растворах озон проявляет большую стойкость. В чистом сухом воздухе он разлагается очень медленно.
При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором. Растворимость озона в воде зависит от рН и содержания в воде растворимых веществ. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона. Присутствие щелочей снижает растворимость О3.
Действие озона в процессе окисления может происходить в трех различных направлениях: непосредственное окисление с участием одного атома кислорода; присоединение целой молекулы озона к окисляемому веществу с образованием озонидов; каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе.
Механизм реакции разложения озона довольно сложен, поскольку на скорость деструкции влияет множество факторов: условия перехода озона из газовой фазы в жидкость, соотношение между парциальным давлением газа и его растворимостью в водном растворе, кинетика окисления озоном находящихся в воде загрязнений.
При диспергировании озона в воду идут два основных процесса — окисление и дезинфекция. Кроме того, происходит значительное обогащение воды растворенным кислородом. Окисление веществ может быть прямое и непрямое, а также может осуществляться катализом и озонолизом.
Примером прямых реакций может служить окисление ряда органических и минеральных веществ (Fe2+, Мп2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты.
Кинетика прямых реакций окисления может быть выражена уравнением:
- ln[cτ] / [c0] = k[O3]τ (II.154)
где [c0], [cτ] — соответственно начальная и конечная концентрации вещества, мг/л; к — константа скорости реакции, л/(моль*с); [О3] — средняя концентрация озона во время прохождения реакции, мг/л; τ — продолжительность озонирования, с.
Непрямое окисление — окисление радикалами, например, группой ОН и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения. Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих в воде загрязнителей.
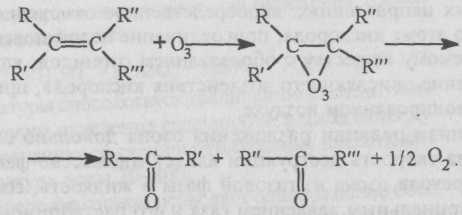
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются:
Катализ — каталитическое воздействие озонирования заключается в усилении им окисляющей способности кислорода, который и присутствует в озонированном воздухе.
Трудно четко определить последовательность и соотношение описанных выше реакций, так как преобладание той или иной формы окислительного воздействия зависит от многих параметров.
Озон получают из кислорода воздуха под действием электрического разряда в генераторах. Перед подачей воздуха или чистого кислорода в генератор его предварительно осушают, так как с увеличением влажности воздуха выход озона уменьшается. Расход энергии на производство 1 кг озона из атмосферного воздуха составляет около 18 кВт ч; из кислорода — около 9 кВт ч.
Озон подают в сточную воду в виде озоно-воздушной или озоно-кислородной смеси. Концентрация озона в смеси — около 3%. Для усиления процесса окисления смесь диспергируют в сточной воде на мельчайшие пузырьки газа. Озонирование представляет собой процесс абсорбции, сопровождаемый химической реакцией в жидкой фазе. Расход озона, необходимого для окисления загрязнений, может быть определен по уравнению массообмена:
М = β 'жF∆cж ,
где М — расход озона, переходящего из газовой фазы в жидкую, кг/с; β'ж — коэффициент массоотдачи в жидкой фазе при протекании в ней химической реакции, м/с; F — поверхность контакта фаз, м2; ∆сж — движущая сила процесса, кг/м3.
Технологические схемы установок для очистки сточных вод озонированием показаны на рис. II-61. На установках предусматривается очистка отходящих газов после реактора от остатков озона. Одноступенчатая установка представлена на рис. II-61,а.

Важным показателем процесса озонирования является величина коэффициента использования озона. В целях увеличения его рекомендуется осуществлять двухступенчатую систему очистки (рис. II-61, б). По этой схеме проводится предварительное озонирование отработанной озоно-воздушной смесью, содержащей ~2мг/л озона. Во втором реакторе происходит окончательное окисление примесей. По схеме на рис. II-61,в процесс ведется также в двух реакторах. В первый подается 80-90% общего количества сточных вод, а остальное — во второй реактор. Озоно-воздушная смесь проходит последовательно реакторы. Концентрация озона в этом случае в отходящих газах не превышает 0,01% (масс).
Для озонирования промышленных сточных вод используют аппараты различной конструкции. Схемы некоторых из аппаратов показаны на рис. II-62. Могут быть использованы также насадочные и тарельчатые колонны и колонны с механическим диспергированием озона.
Поскольку озон приближается к сильным отравляющим веществам (превосходит, например, синильную кислоту), на установках очистки сточных вод озонированием предусматривается стадия очистки отходящих газов от остатков озона.
Для этой цели проводят разбавление газов до безопасных концентраций озона перед их выбросом в атмосферу, деструкцию озона или его утилизацию. Для деструкции остаточного озона применяют адсорбцию, катализ или пиролиз. При адсорбции газы пропускают через колонну с активным углем в виде зерен диаметром 1-6 мм. Недостатком процесса является то, что уголь легко сорбирует органические вещества. В результате он медленно окисляется по мере окисления органических веществ озоном. В среднем затрачивается 450 г активного угля на 1 кг озона.
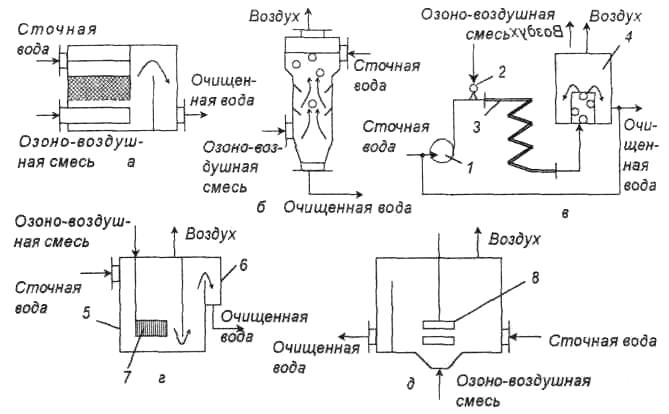
Рис. II-62. Контактные аппараты для озонирования: а — с насадкой; б — барботажная колонна с тарелками; в — с змеевиковым реактором; г — барботажная колонна с пористой пластиной; д — колонна с механическим смесителем турбинного типа: 1 — насос; 2 — инжектор-смеситель; 3 — змеевик; 4 — воздухоотделитель; 5 — контактная камера; 6 — сборная камера; 7 — диффузор; 8 — турбина
Деструкция катализом состоит в быстром разложении озона на кислород и атомный кислород в присутствии катализатора (платиновой сетки) при 60-120°С. Способ эффективен при значительных концентрациях озона в обрабатываемом воздухе. Продолжительность контакта с катализатором не более 1 с. Наличие влаги в газе оказывает отрицательное влияние на эффективность деструкции озона. Присутствие в газе хлора, оксидов азота и других окислителей оказывает химическое воздействие на катализатор. Катализаторы регенерируют в печах при 500°С в течение 6-7 ч.
Пиролиз применяют для деструкции при незначительных концентрациях озона в газе. Процесс проводят при температуре 340-350 оС, его продолжительность 3 с. Наибольшее распространение получили электрические термодеструкторы с рекуперацией энергии, выпускаемые фирмой "Treiligaz" (рис. II-63). Остаточный озон при 20°С поступает в теплообменник, где горячим газом нагревается до 285°С и поступает в камеру нагрева для повышения температуры до 350°С. При этой температуре озон разлагается и чистый газ поступает в теплообменник, где отдает тепло исходному газу. Производительность аппаратов по газу 1350 м3/ч или 21 кг озона в 1 ч.
Для утилизации остаточного озона турбовентиляторами или водокольцевыми компрессорами повышают давление газов до величины, позволяющей направить их в контактные реакторы. Для этой цели используют также механические или гидравлические эмульгаторы.
Процесс очистки сточных вод значительно сокращается при совместном использовании ультразвука и озона, ультрафиолетового облучения и озона. Ультрафиолетовое облучение ускоряет окисление в 102-104 раз. Процесс окисления можно разделить на две стадии: 1) фотохимическое возбуждение молекул под действием УФ-облучения; 2) окисление озоном. На первой стадии образуются высокоактивные в отношении озона свободные радикалы и соединения с низкой молекулярной массой, которые, поглощая свет, окисляются быстрее, чем исходные.
Озон окисляет как неорганические, так и органические вещества, растворенные в сточной воде. Рассмотрим несколько примеров.
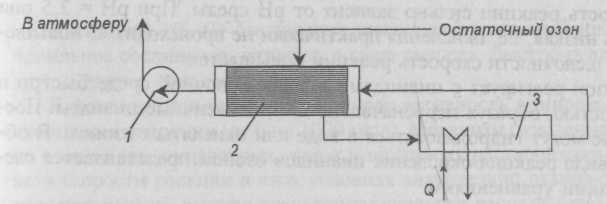 Соединения
металлов окисляются озоном до соединений
высшей валентности. Например, реакции
с соединениями железа и марганца
протекают по следующей схеме:
Соединения
металлов окисляются озоном до соединений
высшей валентности. Например, реакции
с соединениями железа и марганца
протекают по следующей схеме:
Рис. II-63. Схема термодеструктора "Treiligaz": 1 — вентилятор: 2 — теплообменник; 3 — камера электронагрева
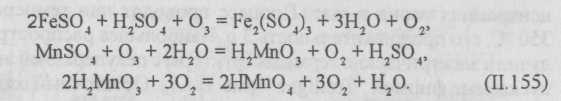
Окисление сероводорода:
H2S + О3 = Н2О + SO2 , 3H2S + 4О3 = 3H2SO4. (II.156)
Тиоцианат-ион (роданид-ионы) реагируют по схеме:
![]()
Процесс окисления рекомендуется проводить в нейтральной или слабокислой среде при температуре 5-25сС.
Аммиак окисляется озоном в щелочной среде до азотной кислоты и воды:
NH3+ 4О3 → 4NO3- + 4 О2+ Н2О + Н+. (II. 158)
С увеличением рН от 7 до 9 скорость реакции возрастает в 10-20 раз. Поэтому с экономической точки зрения озон выгодно применять для окисления аммиака в тех случаях, когда образуются щелочные воды и отпадает необходимость в специальном подщелачивании.
Карбамид в водных растворах может быть окислен озоном до азотной кислоты, диоксида углерода и воды. Особенностью реакции является то, что она начинается через определенный промежуток времени после подачи озона. Чем выше исходная концентрация карбамида, тем меньше времени требуется для начала реакции. Так, при содержании карбамида 50 мг/л процесс окисления начинается через 220 мин, а при 550 мг/л — через 30-40 мин после подачи озона. Скорость реакции сильно зависит от рН среды. При рН = 2,5 она очень низкая, т.е. окисления практически не происходит. С повышением щелочности скорость реакции повышается.
Озон реагирует с цианидами в слабощелочной среде быстро и полностью, образуя первоначально менее токсичные цианаты. Последние могут гидролизоваться в воде или окисляться озоном. В общем виде реакция окисления цианидов озоном представляется следующими уравнениями:
![]()
![]()
Первоначально окисляются свободные цианиды, а затем связанные с металлами комплексы.
Установлено, что скорость окисления озоном цианида в щелочном растворе (рН = 10,5-13,0) практически не зависит от концентрации ионов ОН-. Зависимость скорости реакции окисления от концентрации ионов цианида и озона выражается уравнением:
![]()
Если концентрация озона в газовой смеси постоянна и достаточна для окисления, то
v =-d[CN-]/dτ-k2[CN-]n. (II.161)
При концентрации цианида в растворе, равной 10-4 - 10-2 моль/л, рН раствора 13,5 и скорости подачи озона 17,0 мг/мин n = 0,5.
К фенолам озон проявляет высокую активность в широком диапазоне концентрации (от 0 до 1000 мг/л). Механизм окисления фенола озоном как в кислотных, так и в щелочных растворах одинаков, хотя скорости реакции в этих условиях значительно отличаются. С возрастанием рН значение константы скорости распада фенола увеличивается более чем вдвое. Первичным промежуточным продуктом реакции является катехин, затем о-хинон. После ряда превращений образуются карбоновые кислоты.
Уравнение кинетики распада фенола под воздействием озона:
![]()
где с0, сτ — концентрация фенола в воде соответственно в начале опыта и через время τ ; K1 — константа деструкции фенола, моль фенола на 1 моль озона; R — доза озона, моль/(моль мин); F — скорость подачи озона, м3/мин.
С увеличением скорость и полнота окисления значительно возрастают. Однако глубокое окисление фенола — до СО2 и воды даже при повышенных температурах не экономично.
Высокой реакционной способностью к озону обладают производные фенола о - и м-крезолы. При этом более легко по сравнению с фенолом окисляется м-крезол, труднее о-крезол. С повышением рН наблюдается заметное возрастание эффективности окисления м-крезола с одновременным снижением удельного расхода озона.
Очистка восстановлением. Методы восстановительной очистки сточных вод применяют в тех случаях, когда они содержат легко восстанавливаемые вещества. Эти методы широко используют для удаления из сточных вод соединений ртути, хрома, мышьяка.
В процессе очистки неорганические соединения ртути восстанавливают до металлической ртути, которую отделяют от воды отстаиванием, фильтрованием или флотацией. Органические соединения ртути сначала окисляют с разрушением соединения, затем катионы ртути восстанавливают до металлической ртути. Для восстановления ртути и ее соединений предложено применять сульфид железа, боргидрид натрия, гидросульфит натрия, гидразин, железный порошок, сероводород, алюминиевую пудру и др.
Мышьяк в сточных водах находится в виде кислородосодержащих молекул, а также в виде анионов тиосолей AsS2-, AsS33-. Наиболее распространенным способом удаления мышьяка из сточных вод является осаждение его в виде труднорастворимых соединений. При больших концентрациях мышьяка (110 г/л) метод очистки основан на восстановлении мышьяковой кислоты до мышьяковистой диоксидом серы. Мышьяковистая кислота имеет небольшую растворимость в кислой и нейтральной средах и осаждается в виде триоксида мышьяка.
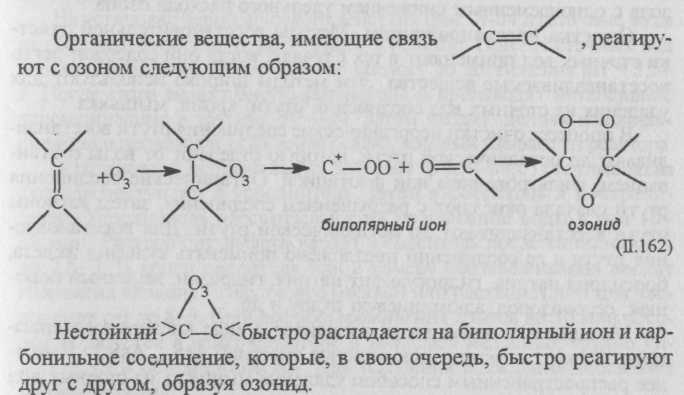
Метод очистки сточных вод от веществ, содержащих шестивалентный хром, основан на восстановлении его до трехвалентного с последующим осаждением в виде гидроксида в щелочной среде. В качестве восстановителей моглт быть использованы активный уголь, сульфат железа (закисного), бисульфат натрия, водород, диоксид серы, отходы органических веществ (например, газетная бумага), пирит-ный огарок и др. На практике для восстановления наиболее часто используют растворы гидросульфита (бисульфита) натрия:
![]()
Реакция протекает быстро при рН = 3-4 и избытке серной кислоты. Для осаждения трехвалентного хрома применяют щелочные реагенты Са(ОН)2 , NaOH и др. (оптимальное значение рН для осаждения 8-9,5):
Сr3+ + ЗОН- = Сr(ОН)3.
Очистку проводят на установках периодического или непрерывного действия.
На установке периодического действия (рис. II-64,a) сточные воды из сборника насосами перекачивают в реактор. При рН сточных вод больше 3 в реактор вводят серную кислоту до достижения рН = 2,5-3. После этого вводят бисульфит натрия и производят интенсивное перемешивание в течение 30 мин. Затем вводят щелочь и полиакриламид и производят осаждение осадка, который удаляют из реактора.
В установках непрерывного действия (рис. II-64,б) сточные воды сначала поступают в усреднитель, затем в смеситель и нейтрализатор. Усреднитель рассчитывают на пребывание воды в нем 10-20 мин. Раствор бисульфата вводят в смеситель после снижения рН до 2,5-3. В конец смесителя или в камеру обезвреживания вводят гидроксид кальция (известковое молоко) или раствор NaOH для увеличения рН до 8-9. Процесс обезвреживания длится до 30 мин. Осадок образуется в нейтрализаторе и выпадает медленно, трудно уплотняется и обезвреживается. Для ускорения осаждения добавляют полиакриламид.
Хорошие результаты получаются при использовании в качестве восстановителя сульфата железа FeSO4. Процесс можно проводить как в кислой, так и в щелочной среде:
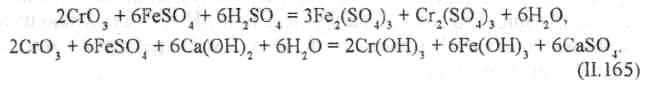
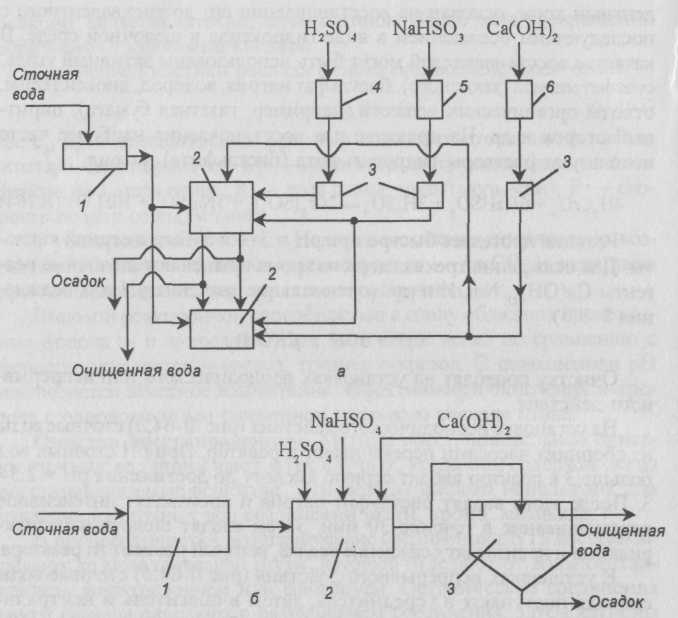
Рис. II-64. Схемы установок для восстановления хрома: a — периодического действия: 1 — сборник, 2 — реакторы, 3 — мерники, 4-6 — емкости; б — непрерывного действия: 1 — усреднитель, 2 — смеситель, 3 — емкость для нейтрализации и отстаивания
Расход FeSO4 зависит от рН среды и концентрации хрома. Наиболее благоприятные условия проведения процесса: температура 20 °С, рН ≈ 7 и расход FeSO4 в 1,3 раза больше стехиометрического.
Восстановление диоксидом серы происходит по схеме:
SO2+H2О→H2SO3 , 2Cr О3 + 3H2SО3→Cr2(SО4)3 + 3H2O. (II.166)
Время, необходимое для полного восстановления Cr(VI) зависит от содержания его в воде. Например, при рН = 3 для уменьшения концентрации Cr(VI) в растворе от 30 до 5 мг/л требуется 1 мин, а от
5 до 0,1 мг/л — 35 мин.
В присутствии соды в сточных водах хром полностью удаляется из них:
6Na2CrO4 + SO2 + Na2CO3 + nH2O = Сr2О3*nН2О + 3Na2SO4 + СО2. (II. 167)
Процесс восстановления проводят при 90°С. После отделения осадка фильтрованием в сточных водах остается только сульфат натрия. Осадок прокаливают при высокой температуре с целью получения стандартного оксида хрома.
В качестве восстановителя можно использовать и гидросульфит цинка или смесь его с известью в различных соотношениях, а также соединения, содержащие фосфор Р(I), природный газ, аммиак, древесный уголь, водород и др.
Возможно также осаждение Cr(VI) в виде нерастворимых соединений без предварительного восстановления его до Сг3+, например, ацетатом бария. В этом случае Cr(VI) осаждается в виде хромата бария. Достоинством этого метода является возможность одновременной очистки сточных вод и от ионов SO42-.
