
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
4. Процессы восстановления металлов
4.1. Термодинамическая характеристика процессов восстановления
Получение чистых металлов за счёт диссоциации их оксидов термодинамически маловероятно из-за весьма низких значений упругости диссоциации соединений.
Наиболее целесообразным является процесс получения металлов из их оксидов путём восстановления. Такой процесс по сути является окислительно-восстановительным (окисленный металл восстанавливается, а восстановитель окисляется) и может быть в общем виде описан реакцией
МеО + В = Ме + ВО, GТ(4.1) , (4.1)
где в качестве восстановителя В может использоваться как твёрдое, так и газообразное вещество (элемент).
Реакция (4.1) по сути, является суммой реакций образования вида
В =
![]() =
ВО, GТ(4.2);
(4.2)
=
ВО, GТ(4.2);
(4.2)
Ме = = МеО, GТ(4.3), (4.3)
которые являются экзотермическими.
Самопроизвольное протекание реакции (4.1) возможно, если GТ(4.2) < GТ(4.3).
4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
Универсальным восстановителем оксидов железа является твёрдый углерод; при восстановлении газообразными часто применяют СО и Н2.
Термодинамика процессов восстановления оксидов железа твёрдыми и газообразными восстановителями в принципе одинакова.
При использовании окиси углерода СО следует рассматривать равновесия в системе FemOn– CO – CO2, которые описываются следующими реакциями:
![]() (4.4)
(4.4)
![]() (4.5)
(4.5)
![]() (4.6)
(4.6)
![]() (4.7)
(4.7)
Равновесные составы газа, соответствующие реакциям (4.4)–(4.7), приведены на рис. 4.1.
Указанные на рис. 4.1 кривые равновесных составов рассчитываются при решении системы, состоящей из двух уравнений:
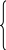
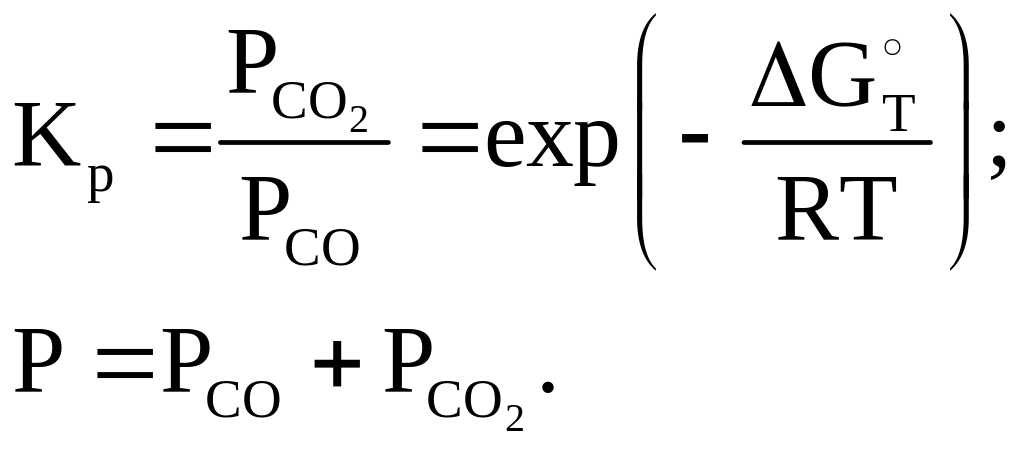 (4.8)
(4.8)
Рис. 4.1. Равновесный состав газовой фазы системы FemOn – CO – CO2
На диаграмме отсутствует зона стабильного существования фазы Fe2O3, поскольку, согласно расчётам, данная фаза является в рассматриваемом интервале температур неустойчивой уже при содержании СО > 0,01%.
Точка О является точкой нонвариантного равновесия с газовой фазой трёх твёрдых фаз.
При использовании в качестве восстановителя водорода либо какого-нибудь иного восстановителя кривые равновесного состава газа будут рассчитываться аналогично.
При использовании в качестве восстановителя оксидов железа углерода процесс можно описать реакциями, отвечающими равновесию в системе Fe2O3 – Fe3O4 – FeO – Fe – C – CO – CO2, содержащей семь компонентов.
Однако с учётом нестабильности Fe2O3, целесообразно проанализировать следующие химические равновесия:
Fe3O4 + CO = 3FeO + CO2;
FeO + CO = Fe + CO2;
2CO = C + CO2.
Кроме частных равновесий, в соответствии с правилом фаз возможно одновременное равновесие пяти фаз – четырёх твёрдых и газообразной (смеси СО и СО2).
Кривые равновесия указанных реакций приведены на рис. 4.2.
Рис. 4.1. Равновесные содержания моноксида
углерода при косвенном восстановлении оксидов
железа и реакции газификации твёрдого углерода
Количественные характеристики равновесий в рассматриваемой системе можно получить, решив совместно уравнения, выражающие зависимость констант от состава газовой фазы. Из решения системы этих уравнений следует, что с увеличением давления в системе температуры начала восстановления оксидов железа возрастают, а с понижением давления – наоборот.
Таким образом, фазовые равновесия в системе Fe–O в присутствии твёрдого углерода определяются температурой и общим давлением газовой фазы (СО + СО2).
