
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
Газы в сталях. Процессы нитридообразования
Для высокотемпературных металлургических процессов характерно взаимодействие металлического расплава со шлаковой и газовой фазами. Полнота и скорость взаимодействия газов прежде всего с жидкими металлами определяет качество металлопродукции.
Растворение двухатомных газов (кислорода, водорода и азота) в жидком металле однотипно, подчиняется закону А. Сивертса (известного как закон квадратного корня) и происходит по реакции
Г2=2[Г]. (6.1)
Константа равновесия реакции (6.1) имеет вид
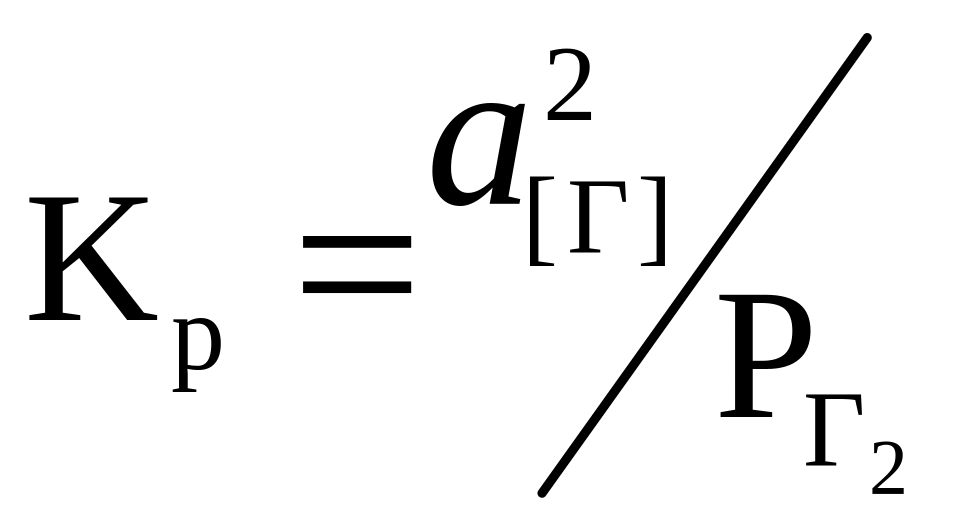 ,
(6.2) где
,
(6.2) где
![]()
Равновесная концентрация
газа [Г] в металле при
![]() =1
атм называется растворимостью и численно
равна константе равновесия реакции
(6.1) для двухкомпонентной системы
«металл-газ».
=1
атм называется растворимостью и численно
равна константе равновесия реакции
(6.1) для двухкомпонентной системы
«металл-газ».
При температуре 1600 °С предельная растворимость кислорода в жидком железе составляет 0,22%, для азота – 0,044%, для водорода – 0,0026%.
Процессы
растворения газов в большинстве металлов
(железе, никеле и др.) являются
эндотермическими, поэтому с увеличением
температуры растворимость газов
возрастает. Исключение составляет
растворимость азота в
![]() -Fe,
которая уменьшается с возрастанием
температуры в точках фазовых переходах
железа из одной модификации в другую
(
-Fe,
которая уменьшается с возрастанием
температуры в точках фазовых переходах
железа из одной модификации в другую
(![]() -Fe
-Fe
![]() -Fe,
-Fe
-Fe,
-Fe
![]() -Fe)
и при плавлении (
-Fe
Fe-ж) равновесные концентрации
газов в растворе меняются скачкообразно.
-Fe)
и при плавлении (
-Fe
Fe-ж) равновесные концентрации
газов в растворе меняются скачкообразно.
Согласно (6.2) на растворимость газов оказывает влияние и давление. С повышением давления равновесие реакции (6.1) смещается в сторону меньшего числа газовых молей, т.е. вправо. Выполнимость закона Сивертса указывает на идеальность образующегося раствора. В присутствии других компонентов, растворенных в металле, равновесные концентрации газов становятся иными. Это влияние можно учесть, используя параметры взаимодействия компонента с растворенным газом.
В случае,
когда
![]() <0,
происходит снижение коэффициента
активности газа в расплаве и повышение
его растворимости. Например, элементами,
повышающими растворимость водорода в
железе, являются титан, ниобий, ванадий.
Снижению растворимости водорода в
железе способствуют такие элементы,
как углерод, алюминий, кремний (для них
<0,
происходит снижение коэффициента
активности газа в расплаве и повышение
его растворимости. Например, элементами,
повышающими растворимость водорода в
железе, являются титан, ниобий, ванадий.
Снижению растворимости водорода в
железе способствуют такие элементы,
как углерод, алюминий, кремний (для них
![]() >0).
>0).
Почти в такой же последовательности влияют указанные компоненты на коэффициент активности азота и его растворимость.
Сильное снижение растворимости водорода и азота при кристаллизации железа и его сплавов сопровождается рядом нежелательных явлений. Водород в молекулярном виде обособляется в дефектных местах (микропустотах) закристаллизовавшегося металла. С уменьшением размеров этих микродефектов при последующей пластической обработке он создает высокие давления, вследствие чего в металле возникают напряжения, ведущие к снижению пластичности, а также нарушению сплошности.
Влияние легирующих
элементов на растворимость азота в
расплавах на основе железа или никеля
можно оценить при помощи экспериментально
установленных
![]() .
.
При взаимодействии азота с расплавами, легированными нитридообразующими элементами, возможно образование раствора Fe-R-N, равновесного с газовой фазой, причем с увеличением содержания R увеличивается растворимость азота.
При определенных содержаниях компонента R из расплава может выделиться тугоплавкое соединение – нитрид RN. Наибольшим сродством к азоту обладают элементы Iva подгруппы Ti, Zr, Hf, которые и используются в основном для связывания азота в жидком металле.
Выделяющиеся из раствора дисперсные карбиды вызывают сильное снижение пластичности металла и повышают его твердость.
Особенности взаимодействия азота с металлическими расплавами отражает диаграмма состояния Me-R-N, фрагмент изотермического сечения которой в областях, богатых металлом, представлен на рис. 6.1.
Линии, ограничивающие области стабильности фаз, описываются соответствующими уравнениями равновесной термодинамики.
Как видно из диаграммы, при небольших количествах нитридообразующего элемента существует двухфазная область стабильности жидкой фазы с газообразным азотом. Координаты линии АВ, разделяющей эту область (I) и область стабильности жидкости (II), можно определить, проанализировав уравнение:
![]()
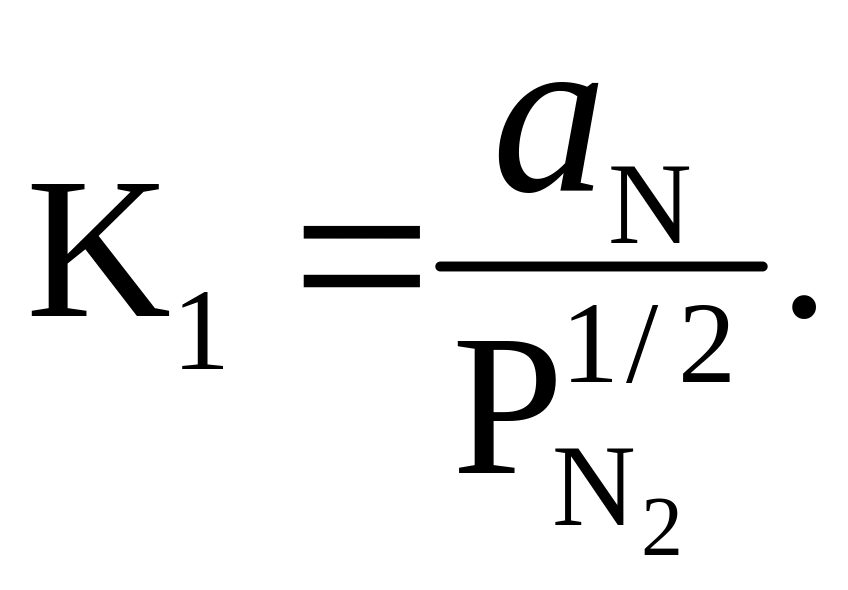 (6.3)
(6.3)
При
![]() атм активность азота равна константе
равновесия реакции (1). Концентрация
азота в точке А равна его растворимости
в бинарной системе Me-N.
атм активность азота равна константе
равновесия реакции (1). Концентрация
азота в точке А равна его растворимости
в бинарной системе Me-N.
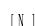
Рис.6.1. Схема изотермического сечения диаграммы состояния системы Me-R-N
На рис. 6.1 показаны следующие области стабильности фаз:
I – ж + N2,
II – ж,
III – ж + RN,
IV – ж + RN + N2.
Пересечение изотермы нитридообразования (ВCD) и линии (АВ), соответствующей растворимости азота в расплаве Fe-R-N при атм, дает точку (В) трехфазного равновесия ж + N2 + RN .
Линии BF и ВЕ, ограничивающие трехфазную область IV, соединяют точку B с фигуративными точками, соответствующими равновесным фазам. Линия BЕ заканчивается на стороне [N][R] концентрационного треугольника в точке, отвечающей соединению RN, а линия BЕ – в точке, соответствующей чистому азоту при атм.
