
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
3.2. Диссоциация оксидов железа
Термодинамика процессов диссоциации оксидов аналогична процессу диссоциации карбонатов, особенности связаны лишь с наличием у некоторых металлов различной степени валентности – в частности, у оксидов железа.
В соответствии с принципом Байкова, диссоциация оксидов железа происходит последовательно, от высшего к низшему вплоть до образования металла. Реакции диссоциации имеют следующий вид:
6Fe2O3 = 4Fe3O4 + O2, GТ = 428 300 281,3 Т Дж ; (3.2)
2Fe3O4 = 6FeO + O2, GТ = 624 400 250,2 Т Дж ; (3.3)
2FeO = Fe + O2, GТ = 529 800 130,7 Т Дж ; (3.4)
1/2Fe3O4 = 3/2Fe + O2, GТ = 553 440 160,2 Т Дж. (3.5)
Указанные оксиды существуют в определенных температурных интервалах. На рис. 3.3 представлены графики зависимостей GТ от температуры реакций (1)–(4).
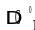
Рис. 3.3. Стандартная энергия Гиббса реакций диссоциации оксидов железа
По рассчитанным величинам упругостей
диссоциации построены зависимости
![]() представленные на рис. 3.4.
представленные на рис. 3.4.
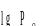
Рис. 3.4. Области устойчивого существования
железа и его оксидов
На данной
диаграмме указаны области устойчивого
существования чистого железа и его
оксидов в широком температурном
интервале. Точка O
соответствует нонвариантному равновесию
с параметрами Т = 575С
и
![]()
26 (в равновесии
находятся четыре фазы – твердые Fe, FeO,
Fe3O4 и О2). На остальных
линиях реализуется нонвариантное
равновесие. Любая точка между линиями
отвечает фиксированному состоянию
бивариантной системы, что позволяет
определить условия устойчивого
существования данной конденсированной
фазы.
26 (в равновесии
находятся четыре фазы – твердые Fe, FeO,
Fe3O4 и О2). На остальных
линиях реализуется нонвариантное
равновесие. Любая точка между линиями
отвечает фиксированному состоянию
бивариантной системы, что позволяет
определить условия устойчивого
существования данной конденсированной
фазы.
3.3. Механизм и кинетика процессов диссоциации
Отличительными особенностями процессов диссоциации, протекающих по реакции вида
АВтв Атв + Вгаз,
являются:
– наличие процесса зарождения новой твёрдой фазы;
– локализация процесса на границе раздела «старой» и «новой» твёрдых фаз;
– зависимость скорости процесса от степени превращения.
В качестве характеристики такого процесса применяют степень превращения :
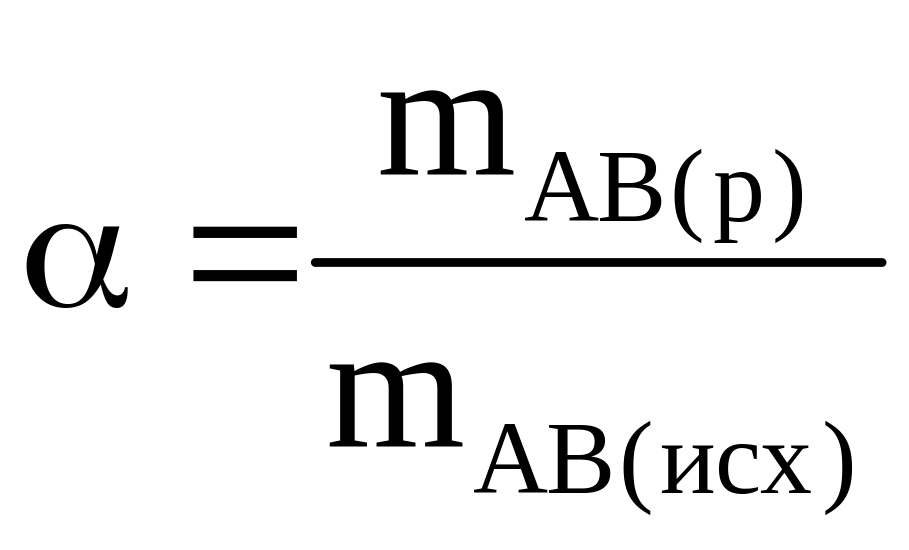 ,
,
где mAB(p), mAB(исх) – равновесное и исходное значения соединения АВ.
Степень превращения зависит от времени процесса, что подтверждено многочисленными экспериментальными данными (рис. 3.5).
Рис.
3.5. Изотермические зависимости степени
превращения
от времени
и скорости превращения
![]() от степени превращения
от степени превращения
При этом можно выделить три этапа:
I – индукционный период, характерный невысокими скоростями процесса из-за трудностей зарождения новой фазы;
II – автокатализ, связанный с ускорением реакции диссоциации;
III – период завершения процесса, что связано с уменьшением количества старой фазы и поверхности раздела.
Экспериментальные исследования процессов диссоциации свидетельствуют о протекании такого процесса по схеме
АВтв АтвВгаз(адс) Атв + Вгаз.
