
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
7. Раскисление металлических расплавов
В процессе окислительного периода плавки стали в сталеплавильном агрегате поступающий в металл кислород (из окислительного шлака, вдуваемый в металлическую ванну газовой струей) расходуется преимущественно на окисление примесей (C, S, P, Si) и некоторых легирующих компонентов, однако часть его остается в металлическом расплаве.
Растворимость кислорода в железе под чистым железистым шлаком оценивают на основе реакции
(FeO) = [Fe] +[O]. (7.1)
![]() .
.
Чипман установил, что для реакции (7.1)
![]() ,
откуда следует
,
откуда следует
![]() .
.
При Т = 1600°С (1873К) предельная растворимость кислорода в железе составляет 0,21%.
Однако в реальных условиях плавки
сталеплавильные шлаки помимо FeO,
содержат многочисленные оксиды и прочие
включения, поэтому
![]() .
Поэтому содержание кислорода в жидкой
стали не достигает предела растворимости
и находится на уровне 0,06…0,08. При этом
при содержании в металлическом расплаве
более 0,05…0,06% С содержание кислорода в
металле определяется развитием реакции
окисления углерода
.
Поэтому содержание кислорода в жидкой
стали не достигает предела растворимости
и находится на уровне 0,06…0,08. При этом
при содержании в металлическом расплаве
более 0,05…0,06% С содержание кислорода в
металле определяется развитием реакции
окисления углерода
[C] + [O] = {CO}. (7.2)
При достижении металлическим расплавом равновесного состояния при Т = 1873 К должно выполняться соотношение [C]·[O] = 0,0025, однако в реальных условиях плавки стали в промышленных агрегатах реакция окисления углерода не достигает равновесия – в частности, из-за условий образования пузырьков СО. В связи с этим по ходу плавки стали под окислительным шлаком содержание кислорода в металле выше равновесного и приближается к нему при содержании углерода менее 0,15%. На рис. 7.1 представлена зависимость содержания кислорода в металлическом расплаве от содержания углерода.
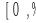
Рис. 7.1 Изменение содержания кислорода в железоуглеродистых расплавах: 1 – равновесная кривая; 2 – область фактических концентраций плавки стали
Фактические концентрации кислорода в стали для всех типов процессов укладывается в одну область. Это свидетельствует, что при [C,%] > 0,05…0,06 реакция окисления углерода оказывает решающее воздействие на содержание кислорода в стали. При [C,%] < 0,05…0,06 содержание кислорода в металле соответствует равновесному с углеродом и бывает ниже его. Следовательно, равновесное со шлаком содержание кислорода в Me достигает величин, соответствующих равновесию с углеродом или даже меньше их.
Реакция (7.2) является экзотермической, поэтому при охлаждении и кристаллизации металлического расплава величина [C]·[O] при Р=const уменьшается; избыточные концентрации кислорода оказываются еще большими, что приводит к образованию газовых пузырей, снижающих плотность слитка, и выделению включений оксидов железа и его растворов с сульфидами по границам зерен кристаллизующегося металла. Эти оксисульфиды придают металлу красноломкость в силу низких температур плавления.
Сильное влияние оказывают и ликвация элементов, особенно кислорода: в процессе кристаллизации его содержание в исходном растворе у фронта растущих кристаллов значительно выше среднего в объеме жидкого металла, что вызывает интенсивное окисление углерода.
В связи с этим одной из основных задач заключительного периода плавки является удаление из жидкой стадии избыточного кислорода, что достигается посредством раскисления металлического расплава.
Под раскислением понимают комплекс операций по снижению содержания кислорода в жидкой стали.
Основными задачами раскисления являются:
– снижение содержания кислорода в жидком железе присадками элементов с большим сродством к кислороду, чем у железа, до уровня, обеспечивающего получение плотного металла;
– создание условий для более полного удаления из жидкой стали продуктов раскисления.
Если первая задача рассматривается с использованием законов химической термодинамики, то вторая решается при помощи аппарата химической кинетики.
Термодинамический подход позволяет выявить связь между содержанием кислорода в жидкой стали и содержанием элемента – раскислителя R, определить степень влияния температуры на характер этой связи, а также рассчитать минимальное содержание кислорода в металлическом расплаве при раскислении его элементом R.
Наиболее распространенным способом раскисления является осаждающий, или глубинный метод, согласно которому вглубь металла вводят элементы с более высоким сродством к кислороду (Si, Al, Ca), чем железо. Эти элементы связывают кислород в прочные неметаллические включения (обычно оксиды), растворимость которых в железе на несколько порядков ниже растворимости FeO. Эти включения обособляются в отдельную фазу в виде мелкой взвеси, которая, имея меньшую плотность по сравнению со сталью, частично всплывает в шлак, а частично остается в закристаллизовавшемся металле в виде неметаллических включений, ухудшая его качество.
Осаждающее (глубинное) раскисление можно описать реакцией вида
![]() .
(7.3)
.
(7.3)
При условии
![]() константа равновесия данной реакции
примет вид
константа равновесия данной реакции
примет вид
 (7.4)
(7.4)
где аi – активность i-го компонента в расплаве.
Для расчета активностей компонентов расплава за стандартное состояние обычно принимают 1%-ный разбавленный раствор.
Диффузионное раскисление достигается при установлении равновесия по реакции
(FeO) = [Fe] +[O]
В основе метода заложено представление о стремлении к равновесному распределению вещества между несмешивающимися жидкими фазами – Me и шлаками. При этом выполняется соотношение
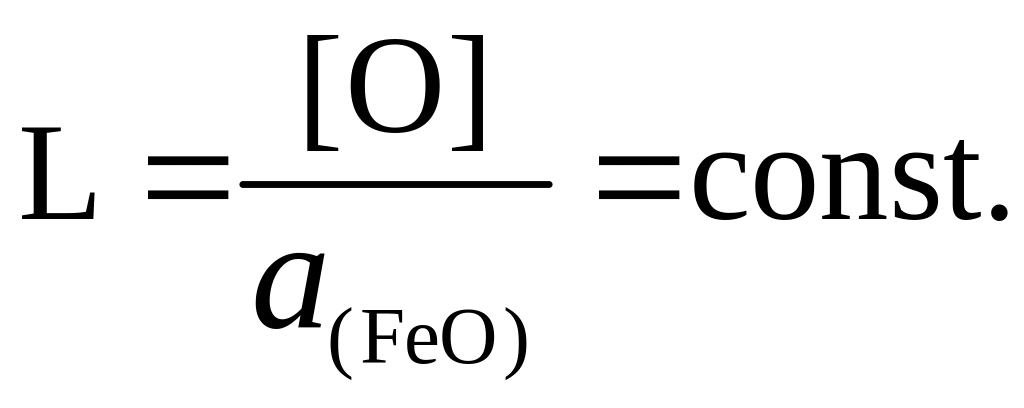 (7.5)
(7.5)
При уменьшении активности оксидов железа в шлаке кислород диффундирует в металле к границе раздела фаз и в виде пар ионов Fe2+ и O2– переходит в шлак.
Достоинством метода является отсутствие в металле каких-либо продуктов реакции после удаления кислорода.
Данный способ реализуется в ДСП с небольшим количеством шлака и низким содержанием кислорода в газовой фазе. В иных сталеплавильных агрегатах диффузионное раскисление сегодня не применяют из-за малых скоростей процесса.
Чаще всего диффузионное раскисление используют как сопутствующий процесс при обработке жидкой стали в ковше синтетическими известково-глиноземистыми шлаками с низким содержанием FeO (менее 1%). При дроблении металла на мелкие капли поверхность контакта «металл-шлак» увеличивается в тысячи раз, наличие конвективных токов ускоряют процесс не только раскисления, но и десульфурацию стали.
Другим способом раскисления является раскисление вакуумом, в основе которого реакция обезуглероживания С (7.2).
Понижение давления смещает равновесие данной реакции в прямом направлении. Достоинством такого метода является отсутствие в металле продуктов раскисления. Этот способ реализуется при внепечной обработке стали.
Существует комплексное раскисление, основанное на применении комплексных раскислителей – сплавов двух или нескольких компонентов (силикокальций, силикомарганец и др.). Преимущества использования таких раскислителей предопределены существенным улучшением термодинамических условий раскисления и более благоприятными кинетическими условиями зарождения, укрупнения и удаления неметаллических включений.
Так, добавка Mn в Fe при раскислении его кремнием приводит к повышению раскислительной способности последнего.
Эффект увеличения раскислительной способности под влиянием второго компонента объясняется уменьшением термодинамической активности образующегося оксида в сложных продуктах раскисления, которые существенно отличаются от продуктов при раздельном раскислении.
Под раскислительной способностью элемента понимают равновесную концентрацию кислорода, растворенного в железе (металле), соответствующей при данной температуре определенному содержанию этого элемента. Очевидно, что чем меньше эта концентрация при данном содержании раскислителя, тем выше раскислительная способность элемента.
Чтобы рассчитать равновесные концентрации кислорода и элемента R, в уравнении (7.3) активности компонентов выражают через их концентрации и коэффициенты активности:
![]() (7.6)
(7.6)
Коэффициенты активности fR и fO можно оценить при помощи параметров взаимодействия первого порядка с учетом принятого стандартного состояния:
lg fR
=
![]() [R]
+
[R]
+
![]() [O]
+
[O]
+
![]() [j]; (7.7)
[j]; (7.7)
lg fO
=
![]() [O]
+
[O]
+
![]() [R]
+
[R]
+
![]() [j].
(7.8)
[j].
(7.8)
Прологарифмировав уравнение (7.6) и выразив концентрацию кислорода через остальные члены суммы, определим раскислительную способность элемента R по равновесной концентрации кислорода:
lg [O] = 1/n lgK R m/n lg [R] m/n lg fR lg fO. (7.9)
Чтобы рассчитать минимальную концентрацию кислорода в металлическом расплаве, раскисляемом элементом R, необходимо продифференцировать уравнение (7.9) по концентрации этого элемента и приравнять к нулю:
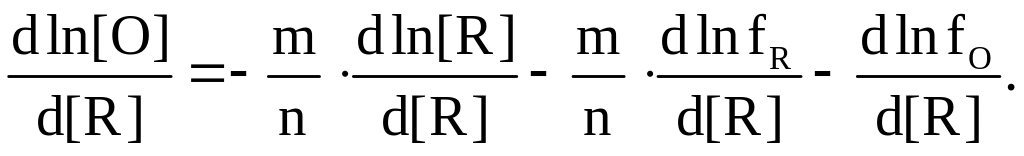 (7.10)
(7.10)
Приравнивая правую часть уравнения (7.10) к нулю и решая его относительно R, находим концентрацию раскислителя R, соответствующую минимальному содержанию кислорода в металле; при этом значения коэффициентов активности компонентов находим по соотношениям (7.7) и (7.8):
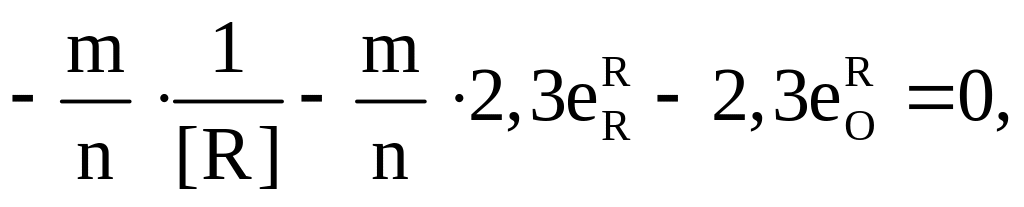 (7.11)
(7.11)
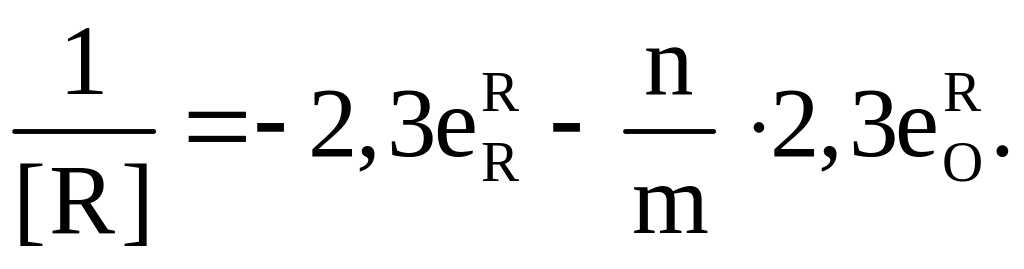 (7.12)
(7.12)
Подставляя значение [R] из соотношения (7.12) в уравнение (7.9), определяем минимальную концентрацию кислорода в металлическом расплаве, раскисляемом элементом R:
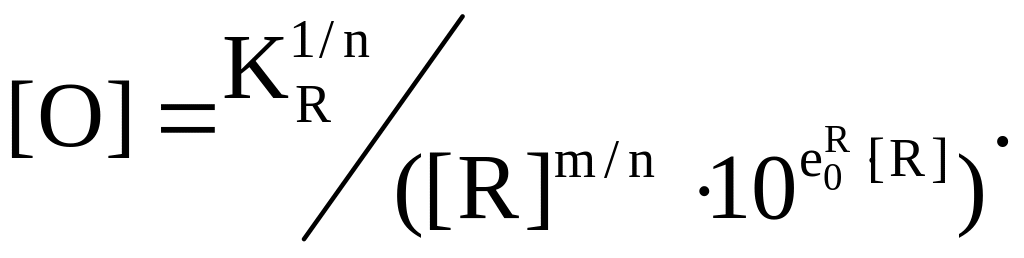 (7.13)
(7.13)
На рис. 7.2 представлены раскислительные способности некоторых элементов в жидком железе при Т = 1600 °С.
Содержание кислорода сложно зависит от [R]. При небольших концентрациях раскислителя с увеличением R содержание кислорода понижается. Дальнейшее увеличение [R] приводит к росту концентрации кислорода в металле. Однако при росте содержания кислорода, вызванного уменьшением коэффициента активности, снижается активность кислорода, что подтверждается и экспериментальными данными. Переломы на кривых зависимостях содержания кислорода в жидком железе на рис. 7.1 являются следствием образования разных продуктов раскисления при изменении содержания раскислителя.
Зарождение продуктов раскисления может осуществляться в гомогенной фазе (так называемое спонтанное зародышеобразование) или на готовых поверхностях (поверхности стенок агрегата, шлака, взвешенные включения, оксидные пленки на раскислителях).
Во всех случаях зарождение новых фаз осуществляется в результате флюктуаций – случайного скопления частиц (атом, ионов), отличающихся по составу от среднего содержания в металле. Эти флюктуации в зависимости от их величины и внешних условий могут исчезать или, преодолев некоторый энергетический барьер, развиваться, перерастая во включения.

Рис. 7.2 Раскислительная способность элементов в жидком железе при Т = 1600°С
Экспериментально подтверждено, что в гомогенной системе при формировании зародышей новой фазы в них первоначально переходят имеющие повышенное сродство к кислороду и вызывающие наибольшее поверхностное натяжение на границе раздела фаз «металл – зародыш новой фазы». При последующем росте включений концентрация активных компонентов, участвующих в процессе формирования новой фазы, снижается. Те компоненты расплава, которые способствуют снижению термодинамической активности оксидов, обособляющихся во флюктуации, облегчают формирование зародышей, а способствующие снижению активности раскислителя и кислорода в металле затрудняют их обособление.
В случае зарождения включений на газовых поверхностях существенным, помимо отмеченных выше для гомогенных фаз, является эффект смачивания поверхности обособляющейся фазой. Чем меньше угол смачивания, тем более мелкие флюктуации становятся зародышами. Формирование зародышей облегчается при преимущественном обособлении веществ, капиллярно-активных на границе раздела фаз.
В случае существенного отклонения от равновесного состояния гомогенное зародышеобразование является определяющим. При снижении перенасыщений того или иного компонента возрастает роль готовых поверхностей как центров зародышеобразования. Влияние готовых поверхностей, особенно при выделении твердых включений, тем более эффективно, чем ближе ориентационное и размерное соответствие кристаллов обособляющегося включения и имеющейся подложки.
Зародившиеся включения (их исходный размер порядка 1 нм) укрупняются в результате коагуляции (соединения) частиц при столкновении и выделении на этих частицах вещества из металлического расплава в связи с перенасыщением раствора. На скорость коагуляции влияет частота и эффективность столкновения частиц, которое происходит вследствие броуновского движения, а также из-за различия скоростей движения, что вызывается неодинаковыми размерами и плотностями частиц и наличием конвективных токов
Конвективные токи обеспечивают доставку продуктов раскисления из глубины металла к поверхности раздела «металл – шлак». Перемещение включения у границы металла со шлаком определяется направлением и величиной равнодействующей ряда сил: выталкивающей (архимедовой) FA, обусловленной разностью плотностей металла и шлака и направленной вертикально вверх; капиллярной Fкап, вызванной градиентом концентрации капиллярно-активных веществ и направленной в сторону более высокой их концентрации; инерционных – центробежной FЦ, вызванной искривлением траектории и направленной в глубь металла, так как плотность включений меньше плотности стали, и силы инерции Fи, направление которой зависит от направления движения частиц: для свободно всплывающих включений она направлена вертикально вверх, а для переносимых потоками – совпадает с направлением потока.
В зависимости от размера и формы включений, раскисленности металла и шлака, гидродинамики потоков, влияние каждой из указанной сил на скорость подхода частицы к поверхности шлака оказывается различным. Крупные включения подходят к границе преимущественно под действием выталкивающей силы, более мелкие – под действием капиллярных, особенно при большом градиенте концентрации кислорода.
С уменьшением поверхности, на которую действуют эти силы, возрастает давление и быстрее реализуется прорыв металлической прослойки. Легче преодолевается такое сопротивление твердыми включениями неправильной формы с острыми гранями, сложнее – с плоскими.
Таким образом, чем полнее раскислена сталь и удалены из нее включения, тем выше качество готового металла.
