
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Южно-Уральский государственный университет
Филиал в г. Златоусте
Кафедра «Общая металлургия»
669.02/.09(07)
Д463
А.Н. Дильдин
Теория металлургических процессов
Учебное пособие
Челябинск
Издательство ЮУрГУ
2008
Введение
Металлургические процессы – это совокупность физических явлений и физико-химических превращений (движение газов, жидких и твердых материалов, тепло- и массообмен, фазовые переходы, окисление и восстановление материалов и т.п.), происходящих в металлургических агрегатах (доменная печь, агломерационная машина, сталеплавильная и нагревательная печи, конвертер) при высоких температурах. Предметом изучения курса «Теория металлургических процессов» являются реакции, протекающие в указанных металлургических агрегатах.
Курс ТМП занимает особое положение среди всех металлургических дисциплин, по сути, он является прикладной физической химией применительно к анализу явлений, происходящих при производстве чугуна, стали и ферросплавов.
Теоретические основы металлургических процессов рассматриваются в определенной последовательности: вначале на основе законов термодинамики анализируются условия равновесия химических процессов, затем – кинетика и особенности механизма процессов. Эти вопросы и являются основными задачами, решаемыми при изучении курса ТМП.
1. Состав и свойства высокотемпературной газовой атмосферы
1.1. Термодинамика газовых атмосфер
Пирометаллургические процессы производства металлургических расплавов (чугун, сталь, сплав) протекают с участием газовых атмосфер, которые могут быть нейтральными, окислительными и восстановительными.
Состав, давление и температура газовой фазы зависят от характера ее взаимодействия с другими фазами, образующимися при получении металлов и сплавов. При этом как промежуточный, так и полный состав газовой фазы весьма однотипен:
продукты полного взаимодействия элементов с кислородом – CO2, H2O(пар), SO3;
продукты неполного взаимодействия с кислородом, диссоциации оксидов и дегазации металлов – CO, SO2, H2,, O2, N2, CH4; инертные газы – Ar, Kr.
Равновесный состав газовой фазы можно рассчитать на основе термодинамического анализа химических реакций, важнейшими из которых являются реакции взаимодействия с кислородом водорода, окиси углерода, метана и сернистого ангидрида.
Данные обратимые реакции описываются следующими химическими уравнениями (на 1 моль О2):
-
2H2 + O2 = 2H2O(пар),
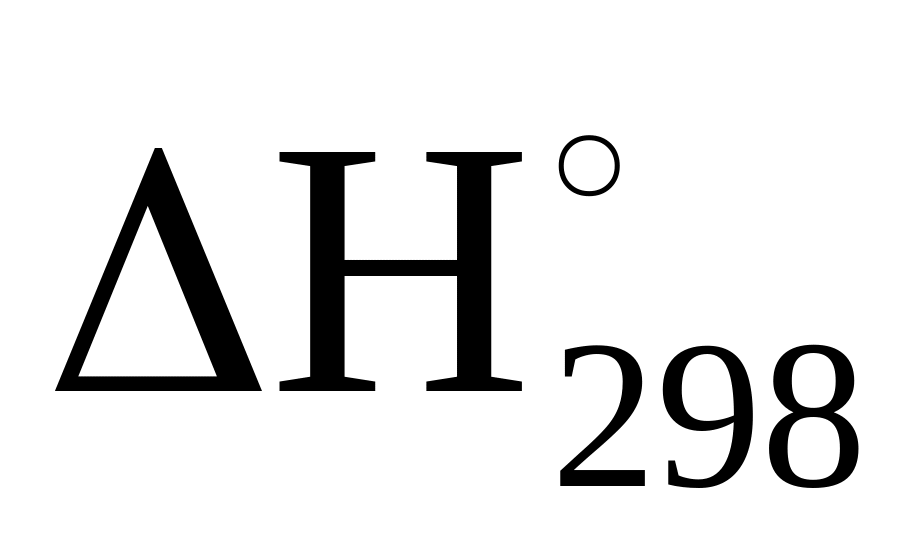 = 484 660 Дж;
= 484 660 Дж;(1.1)
2СО + O2 = 2СО2,
= 566 350 Дж;
(1.2)
2СH4 + O2 = 2СО + 4H2O,
= 71 360 Дж;
(1.3)
1/2СH4 + O2 = 1/2СО2 + Н2О,
= 401 740 Дж;
(1.4)
2SO2 + O2 = 2SO3,
= 196 850 Дж.
(1.5)
Термодинамический анализ данных обратимых реакций позволяет установить равновесные содержания и парциальные давления молекулярного кислорода, а также охарактеризовать окислительно-восстановительные свойства газовой фазы в указанных реакциях.
Рассчитать тепловые эффекты НТ экзотермических реакций (1.1)–(1.5) при высоких температурах можно по уравнению Кирхгофа с использованием табличных данных для определения теплоемкостей процессов [1].
Однако более важной термодинамической характеристикой, которая определяет направление протекания химических реакций, является изменение энергии Гиббса GТ, стандартное изменение которой GТ, в зависимости от температуры для реакций (1.1)–(1.5) имеет вид, Дж:
G(1.1) = 492 200 + 108 Т;
G(1.2) = 565 400 + 175 Т;
G(1.3) = 71 000 + 370 Т;
G(1.4) = 398 230 + 2 Т;
G(1.5) = 196 840 + 196 Т.
На рис. 1.1 представлены графики этих зависимостей.
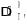
Рис. 1.1. Стандартная энергия Гиббса для реакций горения
Указанные зависимости справедливы при температуре до 2500 К и общем давлении в системе Р=1 атм., т.е. до процессов диссоциации H2О, O2, Н2 на атомы, их ионизации и образования плазмы.
Из анализа приведенных зависимостей и графиков вида GТ = f(Т) на рис. 1.1 следует, что с повышением давления равновесие реакций (1.1), (1.2) и (1.5) смещается в прямом направлении, а с повышением температуры полнота протекания этих реакций уменьшается. Изменение давления не влияет на равновесие реакции (1.4), а прямой ход реакции (1.3) с увеличением давления замедляется. С повышением температуры реакции (1.3) и (1.4) характеризуются большей полнотой протекания.
Равновесный состав образовавшейся атмосферы и парциальные давления ее составляющих компонентов позволят определить и рассчитать окислительно-восстановительные свойства (ОВС) газовой фазы, воздействующей на способные к окислению или восстановлению материалы гетерогенной системы.
Простейшей
количественной характеристикой ОВС
какой-либо газовой смеси является
равновесное парциальное давление
кислорода
![]() .
Однако более точной оценкой ОВС газовой
атмосферы является ее кислородный
потенциал О,
представляющий собой величину химического
потенциала молекулярного кислорода
при отсчете его от стандартного
состояния, при котором
=
1 атм.:
.
Однако более точной оценкой ОВС газовой
атмосферы является ее кислородный
потенциал О,
представляющий собой величину химического
потенциала молекулярного кислорода
при отсчете его от стандартного
состояния, при котором
=
1 атм.:
![]() .
(1.6)
.
(1.6)
Величина О зависит от температуры и от состава газовой фазы, который выражается через отношение парциальных давлений реагентов, влияющих на .
В металлургических агрегатах газовые атмосферы состоят из множества компонентов, которые постоянно участвуют в физико-химических превращениях. Термодинамический анализ таких систем основывается на утверждении, что сложное химическое равновесие достигается в результате одновременного установления в системе всех возможных частных равновесий.
Так, при одновременном протекании в газовой фазе реакций (1.1)–(1.5) при T=const давления указанных компонентов примут значения, соответствующие константам равновесия КР(1.1)–КР(1.5), а кислородный потенциал газовой смеси
![]()
может быть рассчитан по данным любого из этих равновесий, например, по уравнению
![]() (1.7)
(1.7)
В рассматриваемой восьмикомпонентной газовой смеси помимо реакций (1.1)–(1.5) возможны и другие химические взаимодействия между реагентами. Наибольший интерес представляет так называемая реакция водяного газа (водяным газом называют смесь четырех газов Н2 – Н2О – СО – СО2):
Н2 + СО2 = Н2О + СО, G(1.5) = 36 600 33,5T Дж. (1.8)
Анализ этой реакции исключительно важен в металлургии для оценки равновесий в газовых атмосферах при использовании природного газа или увлажненного дутья в доменной печи, других металлургических агрегатах.
Для определения равновесного состава системы реакции (1.8) нужно задаваться не только значением константы равновесия
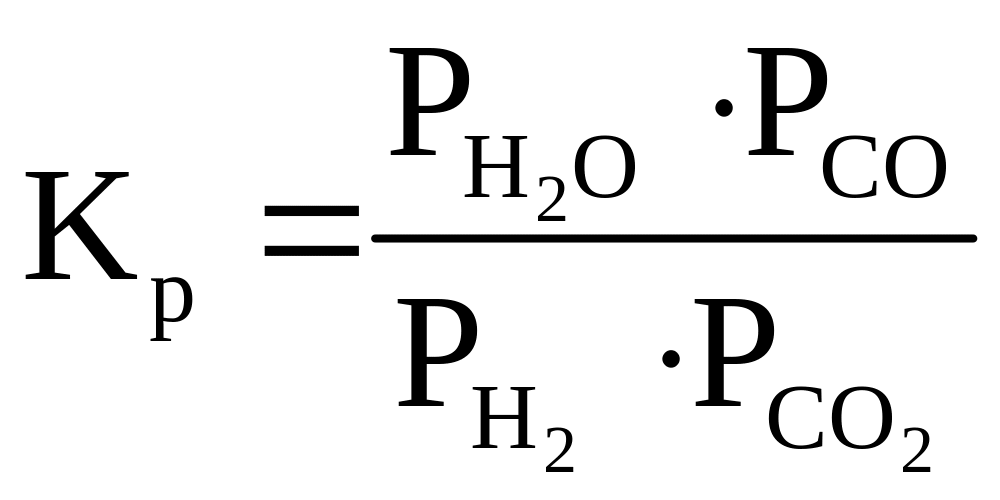 (1.9)
(1.9)
и общим давлением
![]() (1.10)
(1.10)
но и еще двумя какими-либо условиями, что следует из анализа числа степеней свободы:
С = + 2 Ф = 3 + 2 1 = 4.
На практике чаще всего задают исходный состав системы или парциальные давления паров в исходной смеси. В нашем случае кроме Р и Т в качестве двух переменных можно выбрать не изменяющиеся числа молей углерода и водорода или не изменяющиеся суммы парциальных давлений водорода и углеродсодержащих газов:
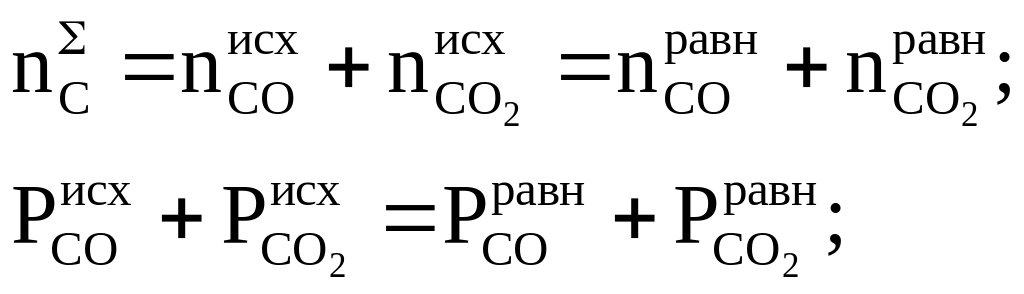 (1.11)
(1.11)
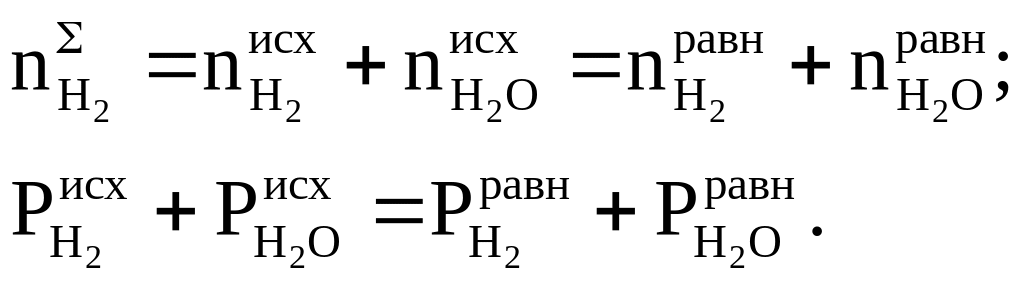 (1.12)
(1.12)
Совместное решение уравнений (1.9)–(1.12) позволяет найти равновесный состав газовой смеси. Результаты расчетов можно представить графически, при этом исходными данными являются соотношения:
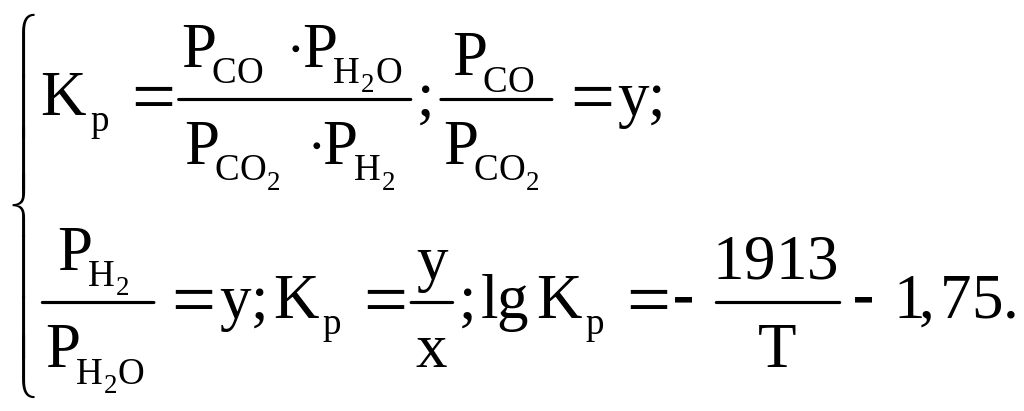 (1.13)
(1.13)
Из графика (рис. 1.2) при заданной
температуре и
![]() можно
определить равновесное с ним отношение
можно
определить равновесное с ним отношение
![]() и наоборот. После вычисления равновесного
значения %СО %СО2
(или %Н2 / %Н2О) можно определить
кислородный потенциал системы СО –
СО2 – Н2 – Н2О и нанести
на рис. 1.2 линии постоянных значений
О.
и наоборот. После вычисления равновесного
значения %СО %СО2
(или %Н2 / %Н2О) можно определить
кислородный потенциал системы СО –
СО2 – Н2 – Н2О и нанести
на рис. 1.2 линии постоянных значений
О.
Рис. 1.2. Соотношение между %СО %СО2 и %Н2 / %Н2О.
