
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
Для металлических расплавов, которые по своей сути являются растворами, характерно сложное физико-химическое взаимодействие между частицами, из которых они состоят. Надёжность термодинамического описания металлургических систем определяется степенью разработки той или иной термодинамической теории. При этом в зависимости от характера принятых тех или иных допущений статистические теории делятся на строгие теории (например, квантово-механические); построенные на численном эксперименте теории; модельные теории.
Последние получили достаточно широкое распространение – это теория совершенных растворов, теория идеальных разбавленных растворов, теория регулярных растворов и другие. Одна из причин введения таких теорий – отсутствие общей термодинамической модели растворов.
При описании термодинамических свойств металлических расплавов из используемых моделей наиболее часто используется метод параметров взаимодействия.
Данный метод используется для учета
влияния всех компонентов раствора на
активность рассматриваемого компонента
(например, компонент А – растворитель,
компоненты В, С и Д – добавленные
примеси). Параметры взаимодействия
определяются в результате разложения
в ряд Тейлора избыточной свободной
энергии
![]() для компонента В около точки, отвечающей
чистому растворителю:
для компонента В около точки, отвечающей
чистому растворителю:
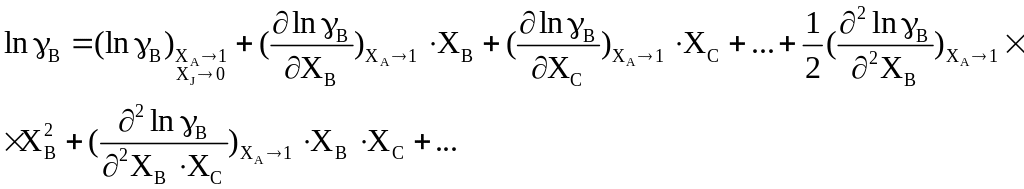 (5.1)
(5.1)
Первые производные
![]() по мольным долям элементов примесей
называют молярными параметрами
взаимодействия первого порядка
по мольным долям элементов примесей
называют молярными параметрами
взаимодействия первого порядка
![]() ,
вторые – второго порядка
,
вторые – второго порядка
![]() и далее – перекрестные параметры
взаимодействия
и далее – перекрестные параметры
взаимодействия
![]() .
.
С учетом этого выражение (5.1) для растворов с невысокими значениями растворенных компонентов (В, С, Д, …) можно записать в виде
![]() .
.
Или для i-го компонента
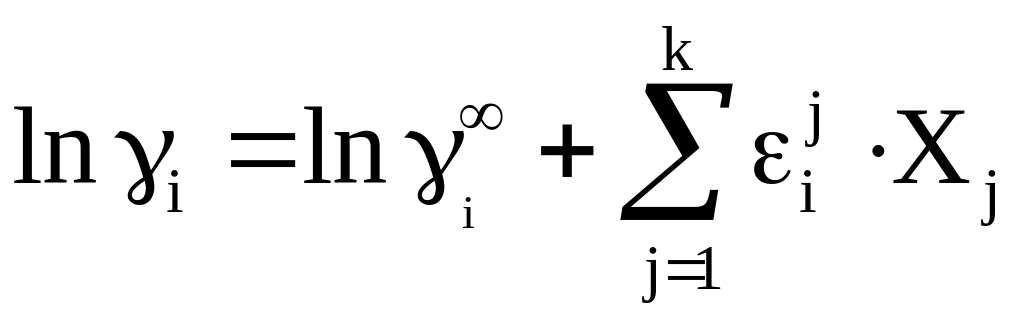 .
(5.2)
.
(5.2)
Для многокомпонентных растворов за стандартное состояние вещества обычно принимают 1%-ный разбавленный раствор. В этом случае вместо (5.2) записывают
![]()
или в общем
виде
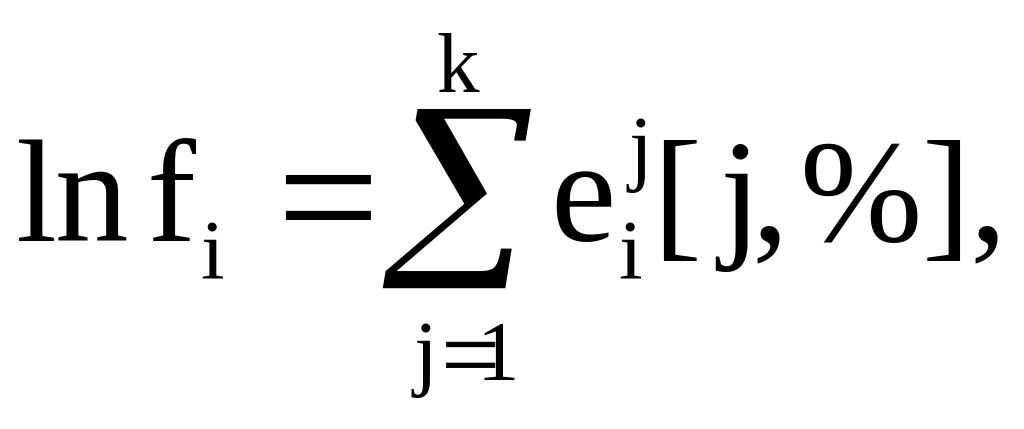 (5.3)
(5.3)
здесь
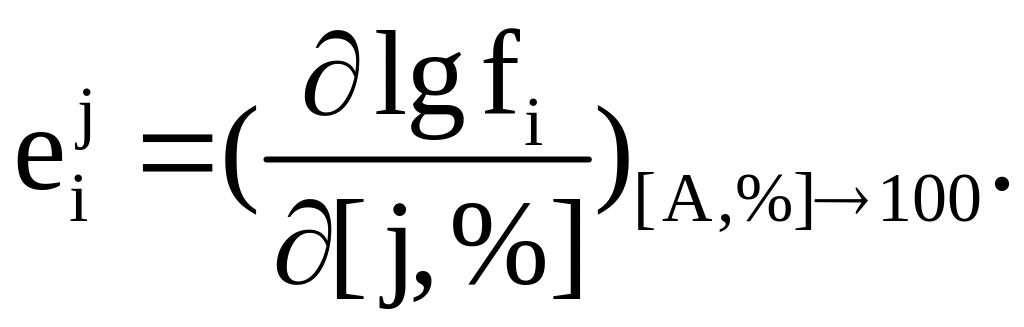
5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
Металлургический шлак является многокомпонентным (преимущественно, оксидным) раствором, вступающим во взаимодействие с металлическим расплавом и газовой фазой металлургического агрегата. В состав шлака могут входить сульфиды, фториды, прочие неметаллические включения. По ходу плавки металла шлак выполняет важнейшие технологические функции (например, такие, как защита металла от атмосферы агрегата; поглощение вредных примесей из металла; участие в окислительных процессах; диффузионное раскисление металла).
Строение шлакового расплава определяется природой структурных единиц и их распределением в пространстве. Комплексное изучение основных физико-химических свойств шлаковых расплавов – вязкости, диффузии, адсорбции, проведенное, в том числе при помощи рентгеноструктурных исследований твердых и жидких шлаков, показало, что в расплавленном состоянии шлаковый расплав состоит из ионов – катионов и анионов.
Состав шлаков существенно влияет на их главные свойства, среди которых следует выделить основность – отношение концентрации оксидов с ярко выраженными основными свойствами, и оксидов, обладающих кислотными свойствами. Далее, в зависимости от состава шлаки подразделяются на основные (в них преобладают основные оксиды – CaO, MgO, MnO и др.) и кислые (SiO2, Al2O3, TiO2).
Состав шлака и его структура влияет на физико-химические свойства: плотность, поверхностные свойства, вязкость, диффузия.
Плотность и мольный объем являются структурно-чувствительными свойствами, данные характеристики используются для расчетов кинетических свойств ионных расплавов. Влияние состава определяется изменением координационного числа и характеризуется изменением свободного объема. Зависимость от температуры связана с изменением межатомного расстояния из-за увеличения амплитуды колебания атомов.
При анализе поверхностных свойств установлено, что для большинства двойных систем поверхностное натяжение линейно меняется с изменением состава.
Другой важнейшей характеристикой шлаковых расплавов является вязкость, изменяющаяся в пределах 0,1…1,0 Па·с (из-за наличия в них крупных структурных единиц типа кремнекислородных комплексов), что выше по сравнению с металлическими расплавами.
Динамическая вязкость η и кинематическое ν связанны соотношением η = 1/ν.
Зависимость вязкости от температуры выражается уравнением
η = Аехр(Еη/RT),
где Еη – энергия активации вязкостного течения.
Термодинамические свойства шлаковых расплавов описываются при помощи различных теорий – молекулярных и ионных, которые основаны на результатах исследований минералогического состава закристаллизовавшегося шлака и обобщении экспериментальных данных.
Вариант молекулярной теории строения жидких шлаков, разработанный Г. Шенком, отличается простотой и основывается на утверждении, что в качестве единичных структур шлака считаются молекулы свободных оксидов (СаО, SiO2, FeO…) и их соединений.
Из многообразия соединений оксидов выбраны 5: 2FeO·SiO2, 3СаО·Fe3O4, 2MnO·SiO2, СаО·SiO2, 4 СаО·Р2О5. Эти соединения удовлетворительно описывают широкий диапазон свойств шлаков, в том числе распределение элементов между металлом и шлаком на основе констант равновесия реакций диссоциаций приведенных соединений.
Однако главная особенность и недостаток молекулярной теории шлаковых расплавов заключается в отсутствии учета реального строения шлаковых расплавов. Тем не менее, накопленный материал позволяет оценивать некоторые термодинамические характеристики – например, активность аi компонентов.
Теория совершенных ионных растворов (автор Темкин М.И.) основывается на утверждении, что шлаковый раствор полностью диссоциирует на ионы (катионы и анионы); ионы одного знака энергетически равны; ближайшими соседями у каждого иона являются ионы противоположного знака; раствор образуется без изменения объема; при тепловом движении возможны перестановки между ионами одного знака. Активность компонентов такого расплава рассчитывается как произведение ионных долей катионов и анионов.
Например, активность сульфида кальция СаS будет определена по соотношению
![]()
где хСа, хS – ионные доли катиона кальция и анионы серы соответственно.
Теория совершенных ионных растворов может использоваться для определения активностей компонентов в сильно основных шлаках, однако увеличение доли SiO2 и Al2O3 до 20% дает сильное расхождение между теорией и опытом, поэтому в практических расчетах равновесий данная теория не используется.
Однако основные статические положения этой модели применимы в теории регулярных ионных растворов, разработанной и опробованной А.В. Кожеуровым.
К особенностям данной теории относятся следующие положения: энтропия раствора не считается идеальной и рассчитывается как по теории совершенных ионных растворов; раствор состоит из простейших атомных ионов (катионов – ионов металла Са2+, Fe2+, Al3+, и анионов – ионов металлоидов О2–, F–, S2–); ближайшими соседями ионов являются ионы противоположного знака; раствор образуется без изменения объема, с выделением или поглощением тепла.
При расчетах химических потенциалов компонентов раствора – как и при определении активности компонентов; в данной теории необходимо учитывать энергию смешения компонентов Qij, которая находится на основании результатов экспериментальных исследований растворов из соединений, содержащих катионы i и j. Для данной теории характерно то, что связь между составом и термодинамическими функциями устанавливается более строго и обоснованно, поэтому точность и надежность расчетов выше.
В полимеризационной теории шлаковых расплавов принято, что образующие растворы ионы энергетически неравноценны, при этом образуются полимеризованные комплексы, в которых энергия связи комплексов с другими структурными единицами раствора.
Согласно теории растворов как фаз с коллективной системой электронов (основные положения разработаны Пономаренко А.Г.) в качестве компонента шлакового раствора выбираются не химические соединения, а элементы периодической системы, поэтому состав раствора выражается в атомных долях. При этом электроны всех атомов раствора образуют единую квантово-механическую систему. Активность соединения АmВn в шлаковом растворе определяется как
![]() ,
,
где
![]() ,
,
![]() – активности элементов А и В.
– активности элементов А и В.
Активность элемента сорта i определяется атомной долей этого компонента и энергией взаимодействия с компонентом j. При этом энергии взаимодействия Еij определяется как
Еij =1/2( χ1/2 – χ1/2)2,
где χi и χj – атомные параметры атомов i и j, определяемые из величин стандартых энтальпий образования различных соединений.
