
- •Теория металлургических процессов
- •Введение
- •1. Состав и свойства высокотемпературной газовой атмосферы
- •1.1. Термодинамика газовых атмосфер
- •1.2. Гомогенные газовые процессы
- •2. Анализ процессов горения твердого углерода
- •3. Оценка прочности химических соединений
- •3.1. Диссоциация карбонатов
- •3.2. Диссоциация оксидов железа
- •3.3. Механизм и кинетика процессов диссоциации
- •При этом образование зародыша новой фазы в недрах старой должно сопровождаться уменьшением энергии Гиббса системы, рассчитываемой по уравнению
- •3.4. Окисление твердых металлов
- •4. Процессы восстановления металлов
- •4.1. Термодинамическая характеристика процессов восстановления
- •4.2. Восстановление оксидов железа твёрдыми и газообразными восстановителями
- •4.3. Механизм и кинетика процессов восстановления
- •5. Металлургические расплавы
- •5.1. Общая характеристика
- •5.2. Металлические расплавы
- •5.3. Термодинамические свойства металлических расплавов. Параметры взаимодействия
- •5.4. Шлаковые расплавы. Состав, строение, термодинамические свойства
- •Газы в сталях. Процессы нитридообразования
- •7. Раскисление металлических расплавов
- •8. Распределение элементов между металлом и шлаком
- •Библиографический список
- •Оглавление
3.4. Окисление твердых металлов
При помещении Ме в атмосферу, содержащую О2 или прочие окислительные газы (СО2, Н2О), поверхность его покрывается окислами, окалиной, толщина которой увеличивается со временем. При высоких температурах данный процесс – высокотемпературная коррозия – развивается весьма быстро и приводит к потере Ме при его нагреве перед прокаткой, ковкой.
Всего из-за окисления Ме ежегодно теряется 18...20 млн т Ме. Окисление Ме – процесс самопроизвольный, но он зависит от ряда факторов.
Процесс окисления состоит из следующих стадий:
внешняя диффузия окислительного газа к поверхности окисла;
внутренняя диффузия в слое окалины;
химический акт (реакция) на границах раздела фаз.
Окалина (МеО) толщиной у находится между двумя средами – между Ме и газом; в ее пределах концентрация О2 падает от границы раздела газ/МеО к границе МеО/Ме, а содержание Ме уменьшается в противоположном направлении. Благодаря этому возможна диффузия веществ в слое окисла, что представлено на рис. 3.7.

Рис. 3.7. Схема окисления металла
Коэффициент диффузии в твердой окалине зависит от ее кристаллического строения, определяемого соотношением мольных долей оксида (VMeO) и Ме (VМе).
При VMе > VMeO образуется пористый слой оксида, через него окислительный газ легко проникает к Ме. Такими свойствами обладают следующие Ме.
-
Ме
K
Na
Ca
Mg
MenOn
K2O
Na2O
CaO
MgO
VMe:
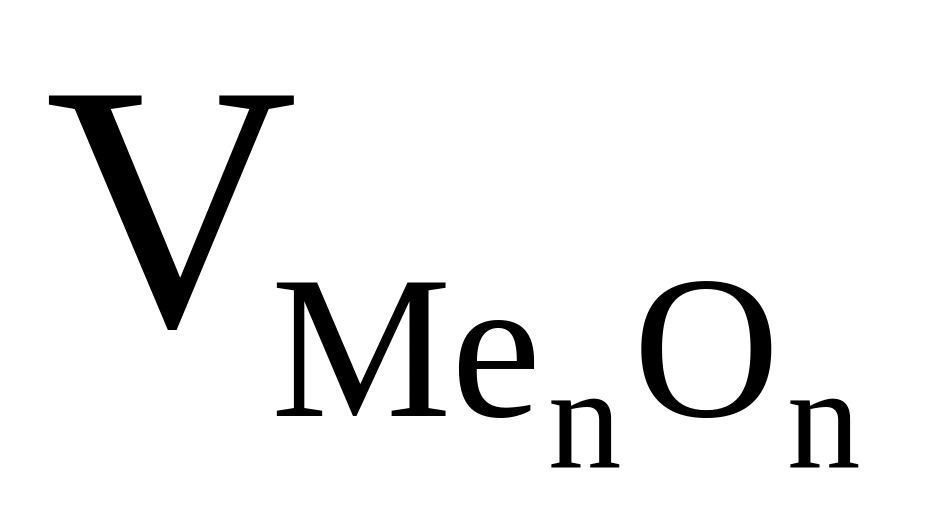
2,44
1,76
1,56
1,27
Если VMе < VMeO, то оксид покрывает Ме сплошным плотным покровом, который создает значительное диффузионное сопротивление и окисление затрудняется. К данной группе относятся следующие Ме:
-
Ме
Al
Ni
Cu
Cr
Fe
MenOn
Al2O3
NiO
Cu2O
Cr2O3
Fe2O3
VMe:
0,805
0,625
0,585
0,492
0,464
В условиях реального окисления металла внешняя диффузия газа протекает сравнительно быстро, поэтому процесс окисления какого-либо металла можно представить в виде двух стадий:
диффузия О2 (другого окислителя) через оксидную пленку;
непосредственно акт химического взаимодействия на границе раздела фаз.
Выведем уравнение зависимости толщины слоя оксида у от времени окисления при T = const.
Наблюдаемая скорость процесса
Vнабл = dy/d.
Скорость внутренней диффузии определяется как
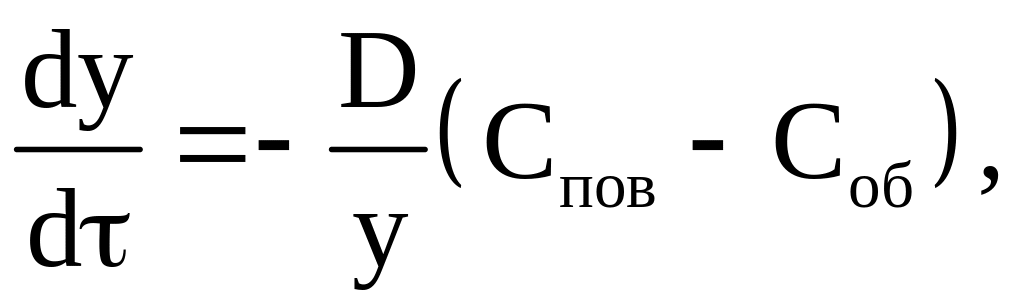
где «» – градиент концентраций;
Спов, Соб – концентрации окислителя на реакционной поверхности и в объеме газа;
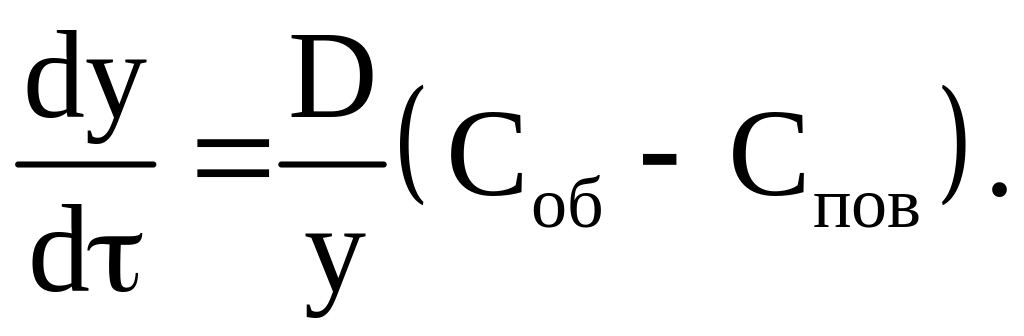
Скорость химической реакции определяется как
![]() ,
,
при n = 1,
![]() ;
;
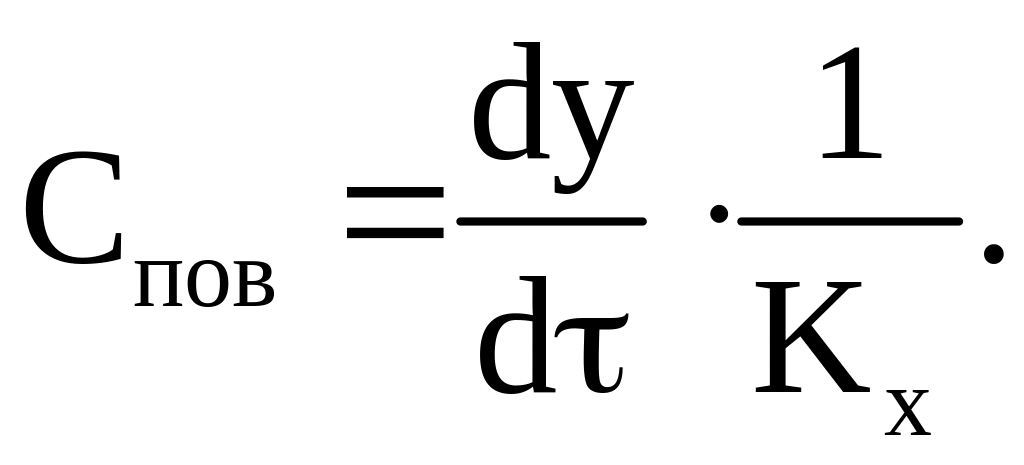
При установившемся режиме скорости последовательных звеньев К и общая скорость равны между собой:
![]()
при этом Спов подставляем в уравнение диффузии:
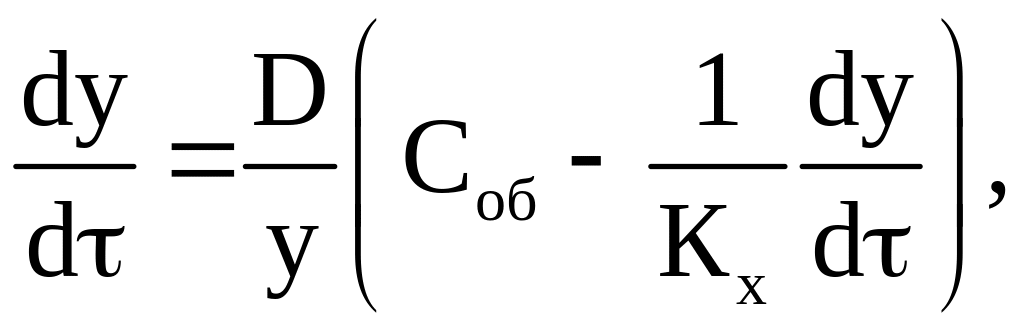
y = f () – дифференциальное уравнение.
Перенесем и разделим переменные:

Начальные условия: = 0, y = 0.
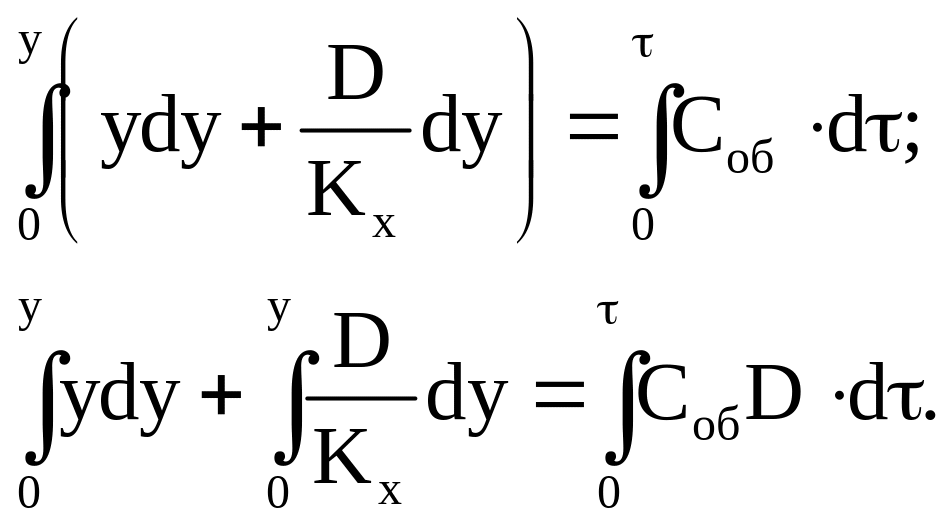
Искомая зависимость толщины окисленного диффузионного слоя от времени:
![]() (*)
(*)
Данная функция является параболической.
При = 0 и y 0 , y2 << y, поэтому величиной y2/2 пренебрегаем:
y = Kx Cоб . (3.6)
Данная зависимость линейная.
Отсюда следует:
толщина слоя окалины ~, т.е. окисление идет с постоянной скоростью;
скорость окисления определяется особенностями величины Кх, т.е. реакция находится в кинетической области.
Данное относится к металлам I-й группы.
Для металлов
второй группы D < R; при этом
– велико. В этом случае слагаемым
![]() пренебрегаем и получаем:
пренебрегаем и получаем:
![]()
![]() .
(3.7)
.
(3.7)
Выводы:
толщина слоя окалины пропорциональна
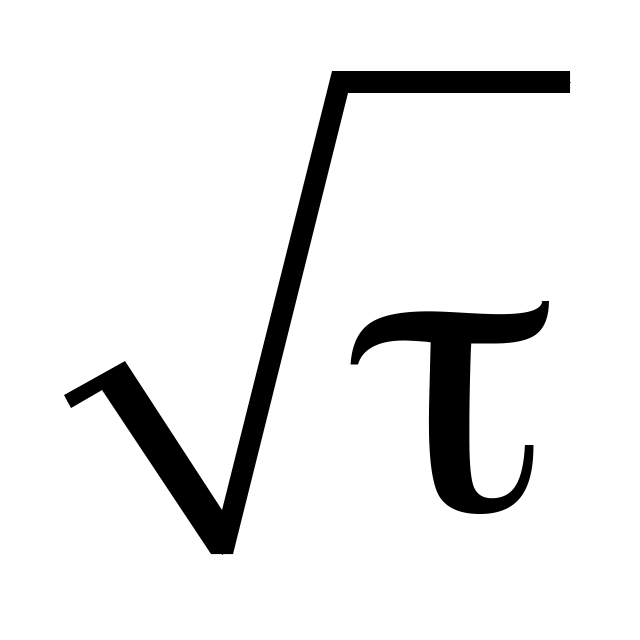 ,
т.е. скорость окисления со временем
уменьшается;
,
т.е. скорость окисления со временем
уменьшается;процесс протекает в диффузионной области.
Графически это показано на рис. 3.8.
Таким образом, у Ме с плотной окалиной реакция окисления вначале находится в кинетической области и слой оксида нарастает по линейной зависимости (на рис. 3.8 – зона 1).
При значительной толщине слоя зависимость становится параболической и процесс лимитируется внутренней диффузией (зона 2). Между этими крайними случаями лежит переходная зона – 3, где y и связаны дифференциальным уравнением (*), которое учитывает особенности химического превращения и диффузии.
Рис. 3.8. Зависимость толщины окалины от времени процесса: 1 – кинетическая область;
2 – диффузионная область; 3 – переходная зона
