
- •1)Азотистый баланс
- •1. Синтез 5'-фосфорибозиламина
- •Реакции синтеза амф и гмф
- •4. Образование нуклеозидтрифосфатов атф и гтф.
- •1) Главные компоненты желудочного сока
- •Реакция взаимопревращения глицина и серина
- •2) Распад пуриновых оснований
- •3) Регуляция синтеза белка
- •4) Обнаружение молочной кислоты в желудочном
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •Механизм реакции синтеза дезоксирибонуклеотида
- •3. Реакция фосфорилирования
- •4) Определение свободной соляной кислоты
- •Окисление аланина
- •3) Синтез амидов из карбоновых кислот
- •1. Особенности обмена метионина
- •2. Обмен цистеина
- •4) Мочевая кислота сыворотки крови
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Переваривание белков в желудочно-кишечном тракте
4) Обнаружение молочной кислоты в желудочном
соке (реакция Уффельмана)
Принцип
Молочная кислота превращает фенолят железа (III)
фиолетового цвета в малодиссоциирующую соль лактата железа
желто-зеленого цвета.
Реактивы
1) 1% раствор фенола, 2) 1% раствор FeCl3, 3) 40% молочная
кислота.
Материал исследования
Нормальный и патологический желудочный сок.
Проведение анализа
Готовят раствор фенолята железа (III), смешивая 2,0 мл
раствора фенола с 3 каплями раствора FeCl3.
Разливают смесь в 3 пробирки:
в первую – по каплям вносят раствор молочной кислоты,
во вторую – нормальный желудочный сок,
в третью – патологический желудочный сок.
При наличии молочной кислоты фиолетовая окраска
заменяется желто-зеленой, при ее отсутствии жидкость
обесцвечивается.
Практическое значение
Появление в желудке продуктов брожения – молочной,
масляной, уксусной кислот – свидетельствует о появлении
микроорганизмов в желудке и развитии процессов брожения. Одной
из причин появления микроорганизмов в желудке является
снижение бактерицидной активности соляной кислоты, либо
развитие патогенной микрофлоры в кишечнике. Поэтому важное
место занимают средства, нормализующие кишечную микрофлору,
к ним относят: бифидумбактерин; бификол; гастрофарм;
149
бактисубтил; лактобактерин. Их применяют при кишечном
дисбактериозе, кишечных инфекциях, колитах и энтероколитах.
Билет №7
-
трансдезаминирование иобобщенно изображают схемой
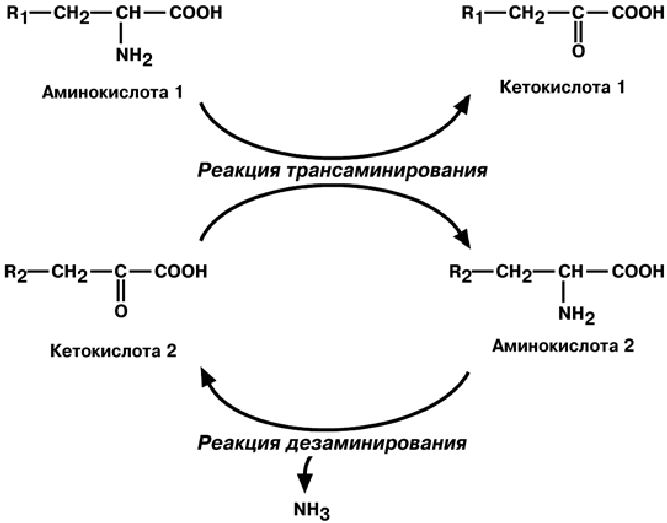
В качестве кетокислоты-акцептора ("кетокислота 2") в организме в основном ис-
пользуется α-кетоглутаровая кислота, она превращается в глутамат и транспортиру-
ет аминогруппу в гепатоциты. Образованные кетоаналоги аминокислот остаются в
клетке и используются как источник энергии.
Роль трансдезаминирования
• Сопряженные реакции трансаминирования и дезаминирования создают поток
лишнего азота из периферических клеток в печень.
• Реакции трансаминирования обеспечивают синтез аминокислот при наличии их
углеродного скелета (кетоаналога).
• Обратимость процессов позволяет клетке использовать при необходимости сво-
бодный аммиак.
2) Креатин – вещество скелетных мышц, миокарда, нервной ткани, в виде креатин-
фосфата является "депо" макроэргических связей, используется для ресинтеза АТФ
во время мышечной работы.
В мышечной ткани креатинфосфат обеспечивает ресинтез АТФ в первые се-
кунды работы (5-10 сек), когда ни анаэробный гликолиз, ни аэробное окисление
глюкозы и жирных кислот еще не активировано, кровоснабжение мышцы не увели-
чено.
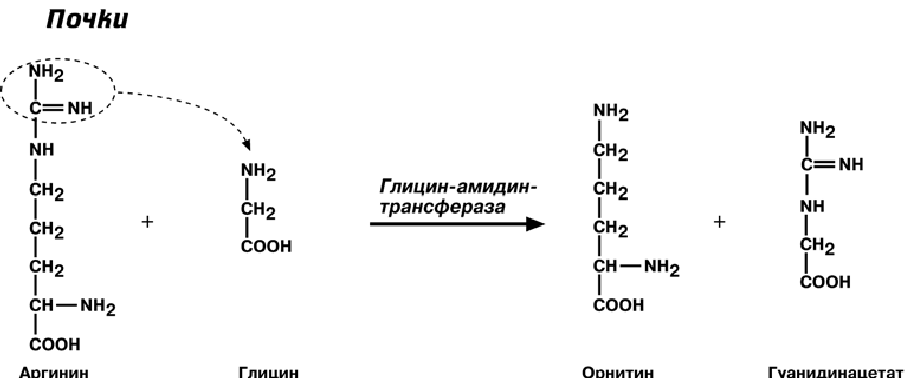
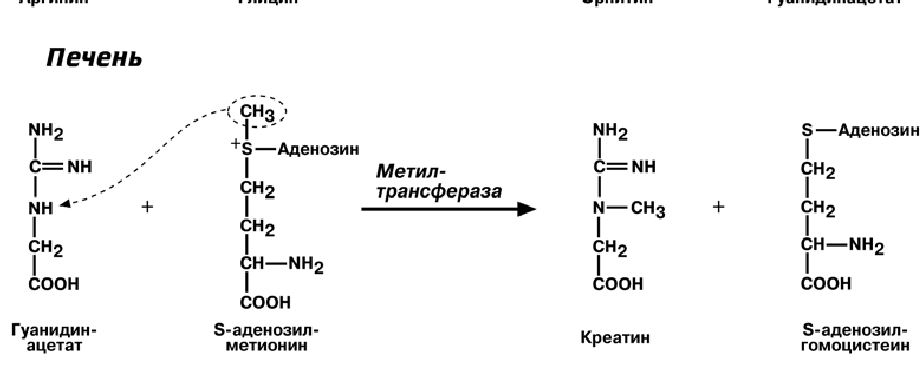
Синтез креатина идет последовательно в почках и печени в двух трансферазных
реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или
мозг. Здесь при наличии энергии АТФ (покой, отдых) он фосфорилируется с образо-
ванием креатинфосфата.
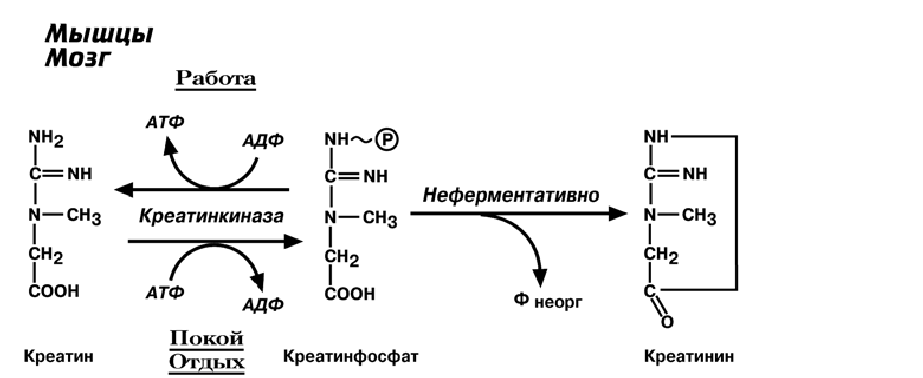
Около 3% креатинфосфата постоянно, в реакции неферментативного дефосфо-
рилирования, превращается в креатинин. Количество креатинина, выделяемое здо-
ровым человеком в сутки, всегда примерно одинаково и зависит только от объема
мышечной массы.
3)
Нуклеиновые кислоты поступают в организм с пищей, главным образом, в со-ставе нуклеопротеинов. После воздействия протеолитических ферментов кишечника из них освобождаются нуклеиновые кислоты. Панкреатический сок содержит рибо-нуклеазы и дезоксирибонуклеазы, гидролизующие нуклеиновые кислоты до полинук-леотидов.
НУКЛЕОПРОТЕИНЫ:
Белок(Протеазы)Аминокислоты
Нуклеиновые кислоты(РибонуклеазыДезоксирибонуклеазы)Полинуклеотиды(Полинукеотидаз)Нуклеотиды(НуклеотидазыФосфатазы)Нуклеозиды(Нуклеозидазы)ПуриныПиримидиныы
После действия панкреатических нуклеаз полинуклеотидазы (или фосфодиэсте-разы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеози-дов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечни-ка деградируют до пуриновых и пиримидиновых оснований.
В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой. Большая часть тех пуринов, что всосались, также превращается в мочевую кислоту, при этом не происходит их включения во вновь образующиеся молекулы нуклеотидов и нуклеи-новых кислот. Как и пурины, свободные пиримидины в основном катаболизируют и выделяются без их использования в организме. Таким образом, нуклеиновые кислоты пищи практически не выступают в роли поставщика непосредственных предшествен-ников нуклеиновых кислот организма. И хотя млекопитающие потребляют значи-тельные количества нуклеиновых кислот и нуклеотидов, их жизнедеятельность не за-висит от всасывания этих веществ или соответствующих продуктов распада.
4) Определение общей кислотности, свободной и связанной
соляной кислоты в одной порции желудочного сока
В работе последовательно исследуются образцы нормального
и трех типов патологического желудочного сока. Сначала
необходимо провести качественные реакции на свободную HCl
(лабораторная работа 1) – если бумага «конго» приобретает синюю,
а диметиламиноазобензол оранжево-красную окраску, то в одной
порции желудочного сока определяют все виды кислотности, как
описано ниже. Если бумага «конго» остается красной, а
диметиламиноазобензол окрашивает содержимое колбы в желтый
цвет, то в этом образце можно определить только общую
кислотность в присутствии фенолфталеина.
Принцип
Метод основан на определении кислотных веществ
желудочного сока путем титрования их раствором NaOH в
присутствии двух индикаторов – диметиламиноазобензола
(интервал перехода рН 2,3-4,2) и фенолфталеина (зона перехода
рН 8,2-10,0). По изменению окраски от красной к оранжевой
индикатора диметиламиноазобензола определяется свободная
кислота, а по переходу окраски фенолфталеина (от бесцветной к
розовой) – общая кислотность желудочного сока.
Реактивы
1) 0,1н NaOH, 2) 1% спиртовой раствор фенолфталеина,
3) 0,5% спиртовой раствор п-диметиламиноазобензола.
Материал исследования
Нормальный желудочный сок, образцы желудочного сока N
1,2,3.
Проведение анализа
В коническую колбу помещают 5 мл исследуемого желудочного
сока, добавляют по 2 капли диметиламиноазобензола и
фенолфталеина. В присутствии свободной HCl наблюдается
красное окрашивание, в отсутствие кислоты – желтое.
Титруют 0,1н раствором NaOH до появления оранжево-красной
окраски и отмечают объем щелочи (мл), пошедшей на титрование
свободной HCl – 1 пункт титрования.
Продолжают титрование до появления лимонно-желтой
окраски и снова отмечают объем щелочи, израсходованной с
начала титрования – 2 пункт титрования.
146
Затем титрование продолжают до появления розовой окраски и
отмечают количество щелочи, пошедшее на все титрование – 3
пункт титрования.
Расчет
За единицу кислотности желудочного сока принимается: объем
0,1н NaOH (мл), необходимого для нейтрализации кислых
эквивалентов в 100 мл желудочного сока (титрационные единицы,
ТЕ) или количество миллимолей соляной кислоты в 1 л желудочного
секрета. Численно эти величины совпадают (например, 40 ТЕ = 40
ммоль/л).
Нормальные величины
Свободная HCl – 20-40 ммоль/л; связанная HСl – 10-20
ммоль/л; общая кислотность 40-60 ммоль/л.
Практическое значение
Определение кислотности желудочного сока имеет важное
значение для диагностики некоторых заболеваний желудка. При
патологии кислотность может быть нулевой, повышенной или
пониженной.
Пониженная кислотность (гипохлоргидрия) встречается при
гипоацидном гастрите, иногда при язвенной болезни желудка.
Ахлоргидрия (полное отсутствие соляной кислоты) и значительное
снижение общей кислотности отмечается при хроническом гастрите
и раке желудка. Отсутствие соляной кислоты и пепсина (ахилия)
часто связаны со злокачественными новообразованиями желудка,
либо со злокачественным малокровием. Ахлоргидрия сопровож-
дается появлением в желудке продуктов брожения – молочной,
масляной, уксусной кислот, так как под влиянием микроорганизмов в
желудке развиваются процессы брожения.
Увеличение содержания свободной НCI и общей кислотности
(гиперхлоргидрия) имеет место при гиперацидном гастрите и часто
сопровождается язвенной болезнью желудка и двенадцатиперстной
кишки. При этих состояниях применяют антацидные средства,
угнетающие секрецию желудочного сока и нейтрализующие
повышенную кислотность. К ним относят: магния окись (оказывает
легкое слабительное и желчегонное действие); фосфалюгель
(состав: гель алюминия фосфата, гель пептина и агар-агара);
альмагель-А (по составу напоминает фосфалюгель, но
дополнительно содержит анестезин для местноанестезирующего
эффекта); гелусил-лак; нео-интестопан; гастал; кальмагин;
сукральфат; мизопростол; даларгин (препарат пептидной структуры,
снижает кислотность желудочного сока, способствует заживлению
язв желудка и двенадцатиперстной кишки); лоперамид (имодиум);
омепразол (угнетает продукцию соляной кислоты в желудке) и др.__
Билет №8
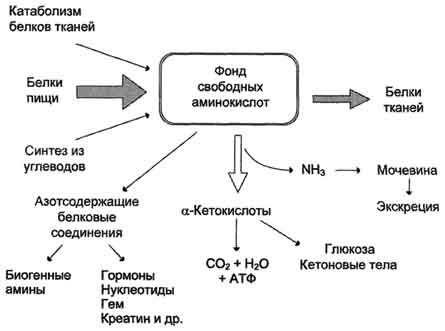
1) Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг.
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1).
Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных.
В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
2) О С Н О В Н Ы Е И С Т О Ч Н И К И А М М И А К А В О Р Г А Н И З М Е .
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее
активными его продуцентами в кровь являются органы с высоким обменом амино-
кислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными его источниками являются следующие реакции:
• неокислительное дезаминирование некоторых аминокислот (серина, треонина,
гистидина) – в печени;
• дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и поч-
ках;
• катаболизм биогенных аминов – во всех ткани, в наибольшей степени в нервной
ткани;
• жизнедеятельность бактерий
толстого кишечника
• распад пуриновых и пирими-
диновых оснований – во всех
тканях.
3) Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному (рис. 9-28).
