- •1)Азотистый баланс
- •1. Синтез 5'-фосфорибозиламина
- •Реакции синтеза амф и гмф
- •4. Образование нуклеозидтрифосфатов атф и гтф.
- •1) Главные компоненты желудочного сока
- •Реакция взаимопревращения глицина и серина
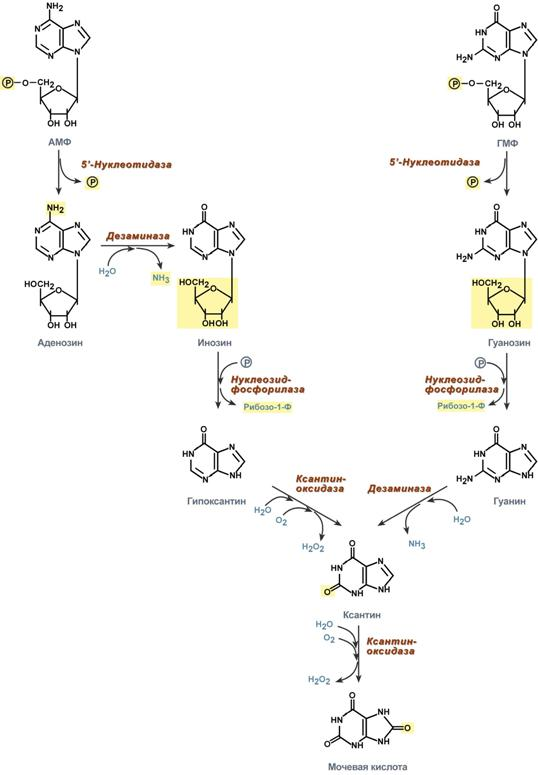
- •2) Распад пуриновых оснований
- •3) Регуляция синтеза белка
- •4) Обнаружение молочной кислоты в желудочном
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •Механизм реакции синтеза дезоксирибонуклеотида
- •3. Реакция фосфорилирования
- •4) Определение свободной соляной кислоты
- •Окисление аланина
- •3) Синтез амидов из карбоновых кислот
- •1. Особенности обмена метионина
- •2. Обмен цистеина
- •4) Мочевая кислота сыворотки крови
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Переваривание белков в желудочно-кишечном тракте
2. Обмен цистеина
Вторая серосодержащая аминокислота - цистеин. Она условно заменима, так как для её синтеза необходим атом серы, источником которого служит незаменимая аминокислота метионин.
Для синтеза цистеина необходимы 2 аминокислоты:
Серин - источник углеродного скелета;
Метионин - первичный источник атома S (см. схему А).
Синтез цистеина из гомоцистеина происходит в 2 стадии под действием пиридоксальзависимых ферментов цистатионинсинтазы и цис-татионинлиазы (см. схему Б на с. 504).
При нарушении использования гомоцистеина в организме из него образуется гомоцистин:
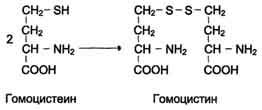
Гомоцистин может накапливаться в крови и тканях" выделяться с мочой, вызывая гомоцистинурию. Возможной причиной является наследственное нарушение обмена гомоцистеина либо гиповитаминоз фолиевой кислоты, а также витаминов В12 и В6. Из других биохимических нарушений можно отметить цистатионинурию, также часто возникающую при недостаточности витаминов группы В.
Биологические функции цистеина разнообразны и очень важны для организма. Так, цис-теин, входящий в состав белков, играет необычайно важную роль в их фолдинге, поскольку тиогруппы цис способны образовывать прочную дисульфидную связь. При этом 2 остатка цистеина формируют молекулу цистина (см. схему В на с. 504).
Окислительная реакция протекает либо с участием кофермента NAD+ под действием фермента цистеинредуктазы, либо неферментативно. Дисульфидные связи стабилизируют пространственную структуру полипептидной цепи или связывают между собой 2 цепи (например, А- и В-цепи гормона инсулина). Очень многие белки и ферменты в активном центре содержат SH-группы, участвующие в катализе. При их окислении ферментативная активность падает (см. разделы 1, 2). Восстановление SH-групп часто

Схема А
503
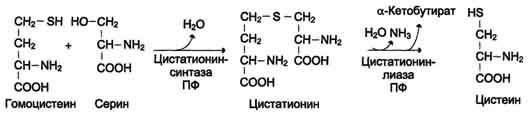
Схема Б
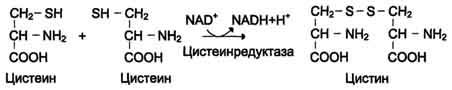
Схема В
происходит с использованием глутатиона - атипичного трипептида, содержащего γ-глутаминовую кислоту, цистеин и глицин (см. схему Г).
Глутатион способен существовать в 2 формах - восстановленной (Г-SH) и окисленной (Г-S-S-F) и служит активным антиоксидантом в организме человека.
Ещё одним важным путём использования цис-теина можно считать синтез таурина в животных тканях, который происходит путём декарбоксилирования производных цистеина - цистеиновой и цистеинсульфиновой кислот:
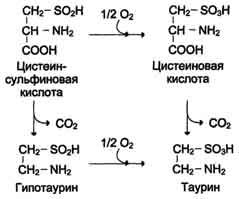
Таурин необходим для синтеза парных жёлч ных кислот в печени. Кроме того, он очень важен в клетках как антиоксидант и используется для снижения ПОЛ и связывания гипохлоританиона (в форме хлораминового комплекса).
Цистеин также служит предшественником тиоэтаноламинового фрагмента HS-KoA (кофермента А).
Катаболизм цистеина происходит окислительным путём (см. схему А .на.с. 505).
Сульфит, который получается в реакции, превращается в сульфат и выводится с мочой, либо превращается в эфиро-серные кислоты, которые также экскретируются почками. Цистеин - практически единственный источник сульфатов мочи.
Пути использования цистеина представлены на схеме (см. схему Б на с. 505).
3)
Генетический код
Генетический (биологический) код – это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырехзначного языка нуклеотидов (А, Г, У, Ц) в двадцатизначный язык аминокислот. Он обладает характерными особенностями:
-
Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
-
Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота.
-
Вырожденность – одной аминокислоте может соответствовать несколько кодонов.
-
Универсальность – биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения).
-
Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
-
Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.
-
Отсутствие знаков препинания – между триплетами нет дополнительных нуклеотидов или каких-либо иных сигналов.
-
Однонаправленность – при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад.
Однако ясно, что биологический код не может проявить себя без дополнительных молекул, которые выполняют переходную функцию или функцию адаптора.
4)
Количественное определение белка
рефрактометрическим методом
Принцип
При переходе из одной прозрачной среды (стекло) в другую
(сыворотка крови) под наклоном к поверхности раздела двух фаз
луч света преломляется. При этом отношение синуса угла падения к
синусу угла преломления называется коэффициентом преломления
80
(рефракции). В сыворотке крови величина рефракции зависит от
количества и состава белков.
Материал исследования: сыворотка крови.
Оборудование: рефрактометр.
Проведение анализа
Проверяют нулевую точку прибора путем определения
показателя преломления дистиллированной воды. Для этого на
чистую поверхность измерительной призмы капают 2-3 капли воды и
опускают осветительную призму. Наводят окуляр на резкость.
Поворотом рефрактометра к свету добиваются наилучшей
освещенности шкалы и штриха. Вращением маховичка "И" границу
светотени вводят в поле зрения окуляра. Вращают маховичок
компенсатора "К" до исчезновения окраски границы светотеней.
Наблюдая в окуляр, маховичком "И" наводят границу светотени
точно на линию штриха. Снимают отсчет по шкале. Показатель
преломления дистиллированной воды равен 1,333.
Измерение показателя преломления сыворотки крови проводят
аналогичным образом.
После проведения измерений поверхности призм очистить
мягкой салфеткой.__
Нормальные величины
Сыворотка крови
дети
взрослые54-85 г/л
новорожденные52-91 г/л
до 3 лет65-85 г/л
Моча 10-140 мг/л
Клинико-диагностическое значение определения общего белка:
Изменения концентрации общего белка могут иметь как
абсолютный, так и относительный характер. Изменения
абсолютного характера являются следствием колебаний
содержания белка в крови, в свою очередь относительные
изменения зависят от объема крови, то есть наблюдаются при
обезвоживании или гипергидратации
Билет №13
1)
Креатин – вещество скелетных мышц, миокарда, нервной ткани, в виде креатин-
фосфата является "депо" макроэргических связей, используется для ресинтеза АТФ
во время мышечной работы.
В мышечной ткани креатинфосфат обеспечивает ресинтез АТФ в первые се-
кунды работы (5-10 сек), когда ни анаэробный гликолиз, ни аэробное окисление
глюкозы и жирных кислот еще не активировано, кровоснабжение мышцы не увели-
чено.
Синтез креатина идет последовательно в почках и печени в двух трансферазных
реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или
мозг. Здесь при наличии энергии АТФ (покой, отдых) он фосфорилируется с образо-
ванием креатинфосфата.

Около 3% креатинфосфата постоянно, в реакции неферментативного дефосфо-
рилирования, превращается в креатинин. Количество креатинина, выделяемое здо-
ровым человеком в сутки, всегда примерно одинаково и зависит только от объема
мышечной массы.
2)
3)
Т Р А Н С К Р И П Ц И Я
Транскрипция (англ. transcription – переписывание), – это биосинтез РНК на мат-
рице ДНК. Биосинтез РНК происходит в участке ДНК, который называется транс-
криптом, с одного края он ограничен промотором (начало), с другого – терминато-
ром (конец).
Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых
элементов:
• матрица – одна из цепей ДНК
• растущая цепь – РНК
• субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ)
• источник энергии – УТФ, ГТФ, ЦТФ, АТФ
• ферменты – РНК-полимеразы.
9
Существует три основных типа РНК-полимераз: для синтеза пре-рРНК (РНК-
полимераза I), для синтеза пре-мРНК (РНК-полимераза II), для синтеза пре-тРНК и
5S-рРНК (РНК-полимераза III).
В составе РНК-полимеразы E.coli выделяют четыре субъединицы: две
α-субъединицы, по одной β- и β’-субъединице. Имеется также дополнительный бел-
ковый σ-фактор Последний необходим только для связывания с промотором и не
участвует в удлинении цепи РНК.
Строение РНК-полимераз эукариот имеет много общего со структурой бактери-
ального фермента: они имеют по две больших субъединицы и несколько малых
субъединиц.
С Т А Д И И Т Р А Н К Р И П Ц И И
Инициация
Промотор содержит стартовый сигнал транкрипции ТАТА-бокс – определенную
последовательность нуклеотидов ДНК, присоединяющий инициирующий
ТАТА-фактор. Этот ТАТА-фактор обеспечивает присоединение РНК-полимеразы к
той нити ДНК, которая будет использоваться в качестве шаблона для транскрипции.
Так как промотор ассиметричен, то он связывает РНК-полимеразу только в одной
ориентации, что определяет направление транскрипции от 5’-конца к 3’-концу
(5’ → 3’).
Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой.
После синтеза затравочного фрагмента РНК длиной 8-10 рибонуклеотидов
σ-фактор отрывается от фермента.
Элонгация
Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы
вдоль ДНК и расплетание нитей ДНК на протяжении примерно 17 нуклеотидных пар.
РНК-полимераза продвигается со скоростью примерно 40-50 нуклеотидов в секунду
в направлении 5’ → 3’. Используя одновременно в качестве субстрата и источника
энергии АТФ, ГТФ, ЦТФ, УТФ.
Терминация
РНК-полимераза остановится, когда достигнет терминирующих кодонов. С по-
мощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ - "ро"),
от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая
является первичным транскриптом, предшественником мРНК или тРНК или__
П Р О Ц Е С С И Н Г Р Н К .
Снтезированные молекулы РНК являются и в дальнейшем претерпевают ряд
изменений, которые называются процессингом. У эукариот процессингу подверга-
ются все виды пре-РНК, у прокариот – только предшественники рРНК и тРНК.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А М Р Н К
1. Кэпирование (англ. cap - шапка) – происходит еще во время транскрипции,
состоит в том, что к 5’-трифосфату концевого нуклеотида пре-мРНК присоединяется
5’-углерод N7-метил-гуанозина. «Кэп» необходим для защиты молекулы РНК от
5’-3’-экзонуклеаз.
2. При транскрипции зон ДНК, несущих информацию о белках,образуются гетерогенные ядерные РНК, по размеру намного превосходящие мРНК. Дело в том, что из-за мозаичной структуры генов эти гетерогенные РНК включают в себя информативные (экзоны) и неинформативные(интроны) участки. При особом процессе сплайсинге (англ.splice – склеивать встык) происходит удаление интронов и сохранение экзонов.
11
3. Полиаденилирование – при помощи полиаденилат-полимеразы с использо-
ванием молекул АТФ происходит присоединение к 3’-концу 100-200 адениловых нук-
леотидов, формирующих поли (А)-хвост.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А Р Р Н К
Предшественники рРНК являются более крупными молекулами по сравнению со
зрелыми рРНК
У прокариот большая прерибосомная 30S-РНК расщепляется специфичными
нуклеазами с образованием 5S-рРНК, 16S-рРНК, и 23S-рРНК.
У эукариот большая прерибосомная 45S-РНК расщепляется специфичными
нуклеазами с образованием 5,8S-рРНК, 18S-рРНК, и 28S-рРНК.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А Т Р Н К
1. Формирование на 3’-конце последовательности Ц-Ц-А. Для этого у одних
пре-тРНК с 3’-конца удаляются лишние нуклеотиды до «обнажения» триплета Ц-Ц-А,
у других идет присоединение этой последовательности.
2. Формирование антикодоновой петли происходит путем сплайсинга и уда-
ления интрона в средней части пре-тРНК.
3. Модификация нуклеотидов путем дезаминирования, метилирования, вос-
становления. Например, образование псевдоуридина и дигидроуридина.__
4)
) Принцип: В рез-те трансаминирования происх. Под действием АсАТ и АлАТ, обр-я оксалоацитат и пируват. Оксалоацетат, подвергаясь декарбоксилированию, превращ в пируват. При добавлении кислого 2,4-динитрофенилшидразина проц.останавливается и получается гидразон пировиногр.к-ты. Последний в щелочной среде дает окрашивание интенсивность кот пропорциональна кол-ву образовавш. Пировиноградной к-ты
Ход: 3 пробирки. В 1 и 2-субтрат д/определ. АлАт, в 3-для АсАТ. В первую-станд.р-р. Во 2 и 3-сыворотку. Перемешивают и инкубируют 30 мин при Т37. Чз пол часа в 3 пробирки вносят реактив динитрофенилгидразина. Перемешивают и оставл.при комн.Т на 10 мин. Затем в 3 проб-р-р едкой щелочи. Перемешивают и колориметрируют чз 10 мин при длине волны 505.
Билет №14
1)
Нуклеопротеиды — комплексы нуклеиновых кислот с белками.
К нуклеопротеидам относятся устойчивые комплексы нуклеиновых кислот с белками, длительное время существующие в клетке в составе органелл или структурных элементов клетки в отличие от разнообразных короткоживущих промежуточных комплексов белок — нуклеиновая кислота (комплексы нуклеиновых кислот с ферментами — синтетазами и гидролазами — при синтезе и деградации нуклеиновых кислот, комплексы нуклеиновых кислот с регуляторными белками и т. п.).
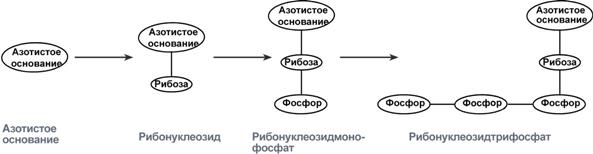
Нуклеоти́ды — фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов.
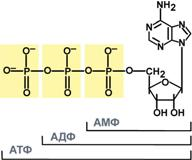
Нуклеозиды — это гликозиламины, содержащие азотистое основание, связанное с сахаром (рибозой или дезоксирибозой).
Нуклеозиды могут быть фосфорилированы киназами клетки по первичной спиртовой группе сахара, при этом образуются соответствующие нуклеотиды.[1]
2) Когда в пищеварительном тракте или в эксперименте белки расщепляются на более простые соединения, то через ряд промежуточных стадий (альбумоз и пептонов) они расщепляются на полипептиды и, наконец, на аминокислоты. Аминокислоты в отличие от белков легко всасываются и усваиваются организмом. Они используются организмом для образования собственного специфического белка. Если же вследствие избыточного поступления аминокислот их расщепление в тканях продолжается, то они окисляются до углекислого газа и воды. В митохондриях пировиноградная кислота - промежуточный продукт, образовавшийся в анаэробной фазе - окисляется до СО2 в шести последовательных реакциях, в каждой из которых пара электронов переносится на общий акцептор - кофермент никотинамидадениндинуклеотид (НАД). Эту последовательность реакций называют циклом трикарбоновых кислот, циклом лимонной кислоты или циклом Кребса. Из каждой молекулы глюкозы образуется 2 молекулы пировиноградной кислоты; 12 пар электронов отщепляется от молекулы глюкозы в ходе ее окисления, описываемого уравнением:
![]() <=""
div="">
<=""
div="">
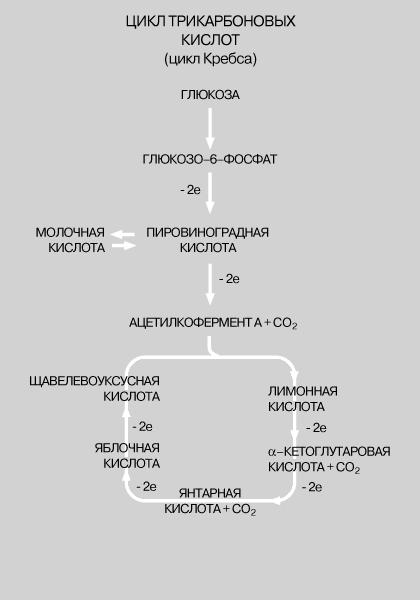 У
ЧЕЛОВЕКА И ДРУГИХ ЖИВОТНЫХ главным
источником энергии служит окисление
глюкозы в тканях. Расщепление глюкозы,
протекающее через ряд этапов, приводит
к образованию соединения, называемого
ацетилкоферментом А. С него начинается
цикл реакций, непрерывно подпитываемый
новыми порциями ацетилкофермента А. В
ключевых точках этого процесса происходит
выделение энергии с переносом двух
электронов (на схеме -2e означает, что
данная реакция идет с выделением
энергии).
У
ЧЕЛОВЕКА И ДРУГИХ ЖИВОТНЫХ главным
источником энергии служит окисление
глюкозы в тканях. Расщепление глюкозы,
протекающее через ряд этапов, приводит
к образованию соединения, называемого
ацетилкоферментом А. С него начинается
цикл реакций, непрерывно подпитываемый
новыми порциями ацетилкофермента А. В
ключевых точках этого процесса происходит
выделение энергии с переносом двух
электронов (на схеме -2e означает, что
данная реакция идет с выделением
энергии).
3)
После считывания информации с ДНК и переноса ее на матричную РНК начина-
ется синтез белков. Каждая зрелая мРНК несет информацию только об одной поли-
пептидной цепи. Если клетке необходимы другие белки, то необходимо транскриби-
ровать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных
белоксинтезирующих органеллах, и включает 5 ключевых элементов:
• матрица – матричная РНК
• растущая цепь – полипептид
• субстрат для синтеза – 20 протеиногенных аминокислот
• источник энергии – ГТФ
• ферменты – рибосомальные белки и рРНК
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
16
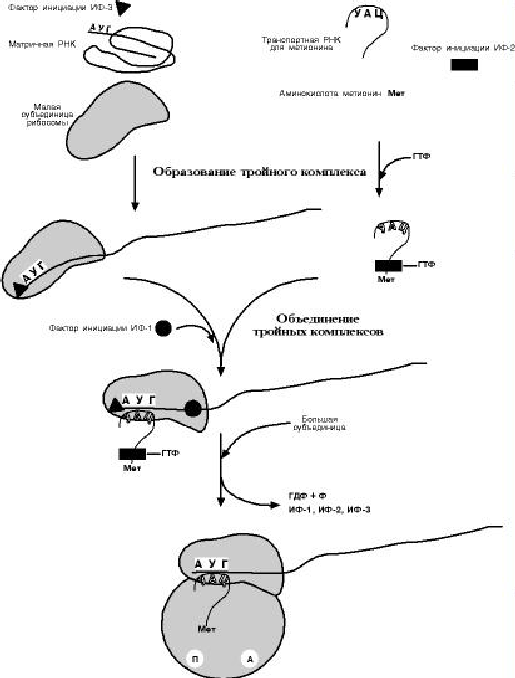
И Н И Ц И А Ц И Я
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосо-
мы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для ме-
тионина
В начале этой стадии формируются два тройных комплекса: первый – мРНК, ма-
лая субъединица, ИФ-3; второй – мет-тРНК, ИФ-2, ГТФ. После их объединения и
присоединения большой субъединицы начинается стадия элонгации.
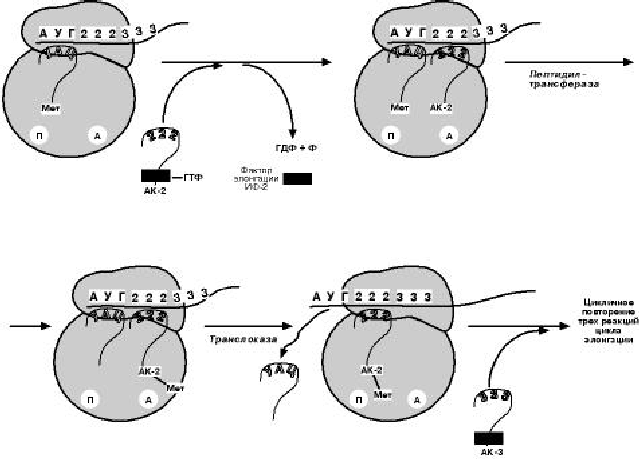
Э Л О Н Г А Ц И Я
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот,
белковые факторы элонгации, ГТФ. Элонгация представляет собой циклический
процесс, повторяющийся столько раз, сколько аминокислот необходимо включить в
полипептидную цепь. Удлинение цепи происходит со скоростью примерно 20 амино-
кислот в секунду.
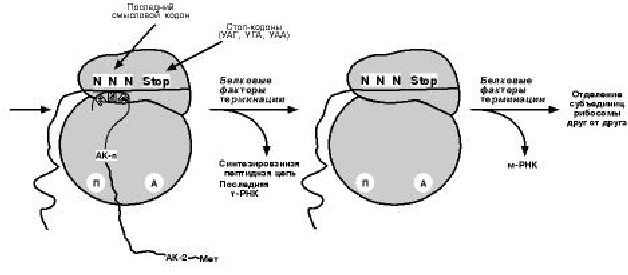
Т Е Р М И Н А Ц И Я
Синтез белка будет продолжаться до тех пор, пока рибосома не достигнет на
мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные три-
плеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны.
Кроме стоп-кодонов для окончания синтеза белка требуются ГТФ и белковые факто-
ры терминации, которые последовательно катализируют
1. Гидролитическое отщепление полипептида от конечной тРНК
2. Отделение от П-участка последней, уже пустой, тРНК,
3. Диссоциацию рибосомы.