- •1)Азотистый баланс
- •1. Синтез 5'-фосфорибозиламина
- •Реакции синтеза амф и гмф
- •4. Образование нуклеозидтрифосфатов атф и гтф.
- •1) Главные компоненты желудочного сока
- •Реакция взаимопревращения глицина и серина
- •2) Распад пуриновых оснований
- •3) Регуляция синтеза белка
- •4) Обнаружение молочной кислоты в желудочном
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •Механизм реакции синтеза дезоксирибонуклеотида
- •3. Реакция фосфорилирования
- •4) Определение свободной соляной кислоты
- •Окисление аланина
- •3) Синтез амидов из карбоновых кислот
- •1. Особенности обмена метионина
- •2. Обмен цистеина
- •4) Мочевая кислота сыворотки крови
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Переваривание белков в желудочно-кишечном тракте
1) Главные компоненты желудочного сока
Париетальные клетки желудка секретируют соляную кислоту — важнейшую составляющую желудочного сока. Основные её функции: поддержание определённого уровня кислотности в желудке, обеспечивающего превращение пепсиногена в пепсин, препятствование проникновению в организм болезнетворных бактерий и микробов, способствование набуханию белковых компонентов пищи, подготовка её к гидролизу.
Пепсин является основным ферментом, с помощью которого происходит расщепление белков. Существует несколько изоформ пепсина, каждая из которых воздействует на свой класс белков. Пепсины получаются из пепсиногенов, когда последние попадают в среду с определённой кислотностью. За продукцию пепсиногенов в желудке отвечают главные клетки фундальных желёз.
Слизь — важнейший фактор защиты слизистой оболочки желудка. Слизь формирует несмешивающийся слой геля, толщиной около 0,6 мм, концентрирующий бикарбонаты, которые нейтрализуют кислоту и, тем самым, защищают слизистую оболочку от повреждающего действия соляной кислоты и пепсина. Продуцируется поверхностными добавочными клетками.
Внутренний фактор (фактор Кастла) — фермент, переводящий неактивную форму витамина B12, поступающую с пищей, в активную, усваиваемую. Секретируется париетальными клетками фундальных желёз желудка.
Образование соляной кислоты
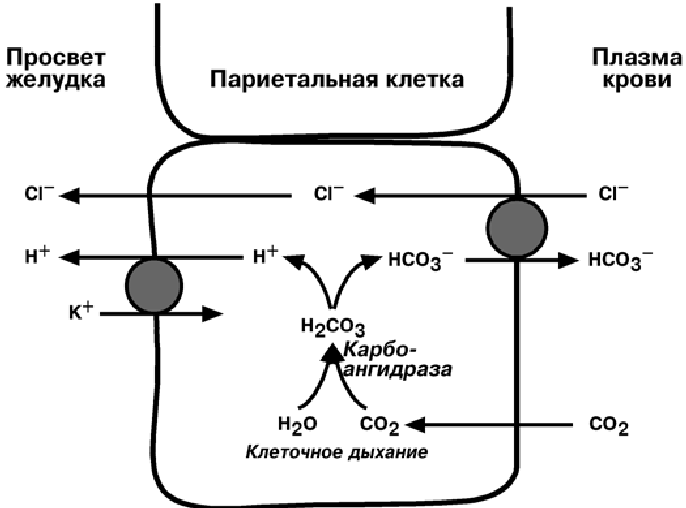
В норме желудочный сок здорового человека содержит 0,4 — 0,5 процента соляной кислоты. Это и есть нормальная кислотность. Однако, и повышенная, и пониженная кислотность желудочного сока сами по себе болезнью не являются. Но очень часто такие изменения говорят о серьезных нарушениях работы желудочно-кишечного тракта, печени, поджелудочной железы.
2) Трансаминирование.
происходит обратимая реакция – перенос NH2-группы с аминокислоты
на другую кетокислоту. Последняя при этом превращается в
аминокислоту.
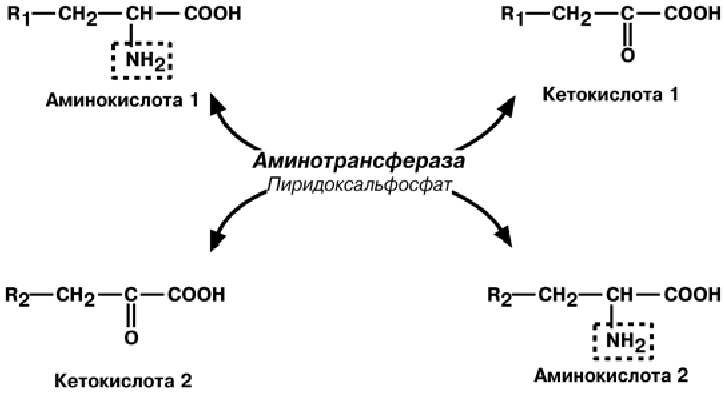
Механизм реакции трансаминирования достаточно сложен и протекает по прин-
ципу пинг-понг. Аминотрансферазы являются сложными ферментами, в качестве
кофермента они имеют пиридоксальфосфат (активная форма витамина В6). Сна-
чала к нему присоединяется аминокислота, превращается в кетокислоту и отделяет-
ся. Аминогруппа при этом переходит на кофермент и образуется пиридоксамин-
фосфат. После этого присоединяется другая кетокислота, получает аминогруппу,
образуется новая аминокислота и регенерирует пиридоксальфосфат.
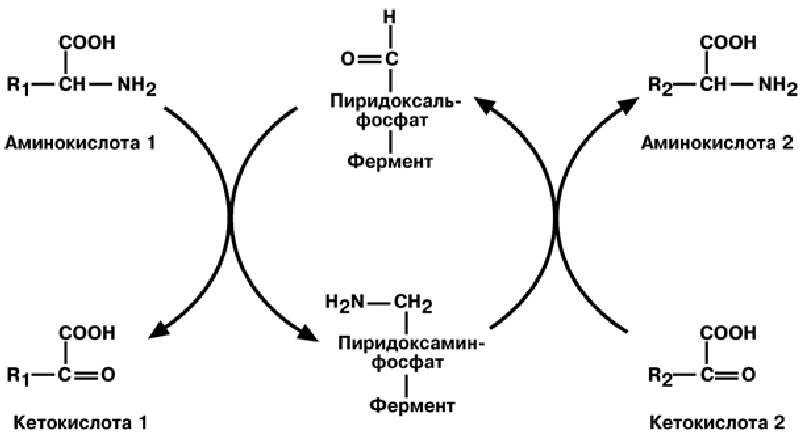
Роль пиридоксальфосфата сводится к образованию промежуточных соедине-
ний – шиффовых оснований (альдимин, кетимин).
Трансаминирование активируется:
• при поступлении в клетку избыточного количества аминокислот;
• при прекращении использования аминокислот на синтез азотсодержащих соеди-
нений: белков, креатина, фосфолипидов, пуриновых и пиримидиновых основа-
ний;
• при гипогликемиях различного генеза, сахарном диабете, т__________.е. при внутриклеточ-
ном голодании.
В результате аминокислоты теряют NH2-группы и превращаются в соответст-
вующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями
и вовлекается в цикл трикарбоновых кислот, где сгорает до СО2 и Н2О.
3) Р Е П Л И К А Ц И Я Д Н К
Синтез ДНК в клетке происходит не беспорядоч-
но, а в строго определенный период жизни клетки.
Всего выделяют 4 фазы: митоз (М), синтетическую
(S), пресинтетическую (G1, от англ. gap - интервал),
постсинтетическую (G2).
Важное участие в регуляции смены фаз клеточно-
го цикла занимают циклины – белки массой
35-90 кДа, уровень которых меняется в ходе клеточ-
ного цикла. По функции циклины – это активаторные
субъединицы ферментов циклин-зависимых киназ
(ЦЗК). Активные комплексы циклин-ЦЗК фосфорили-
руют внутриклеточные белки, изменяя их активность. Этим обеспечивается продви-
жение по клеточному циклу.
Синтез (репликация, удвоение) ДНК про-
исходит в S-фазу клеточного цикла.
Механизм репликации, как установили экс-
перименты Мэтью Мезельсон и Франклин
Сталь в 1957 г, полуконсервативный, т.е.
на каждой нити материнской ДНК синтезиру-
ется дочерняя копия.
Весь процесс репликации идет в S-фазу
клеточного цикла, в то время, когда клетка
готовится к делению.
Как матричный биосинтез, репликация
требует наличия нескольких условий:
• Матрица – в ее роли выступает материнская ДНК;
• Растущая цепь – дочерняя ДНК;
• Субстраты для синтеза – dАТФ, dГТФ, dЦТФ, ТТФ;
• Источник энергии – dАТФ, dГТФ, dЦТФ, ТТФ;
• Ферменты.
Синтез ДНК начинается в определенных участках, получивших название точка
ori (англ. origin - начало). На каждой ДНК млекопитающих точек o r i насчитывается
около 100. Репликация распространяется от этих участков в обе стороны по нитям
ДНК с образованием "репликативных пузырей". В каждом таком "пузыре" имеются
две "репликативные вилки", в которых происходит расплетание, раскручивание и
непосредственный синтез ДНК. Репликативные вилки удаляются друг от друга. В це-
лом вся репликация ДНК у эукариот заканчивается за 9 часов.
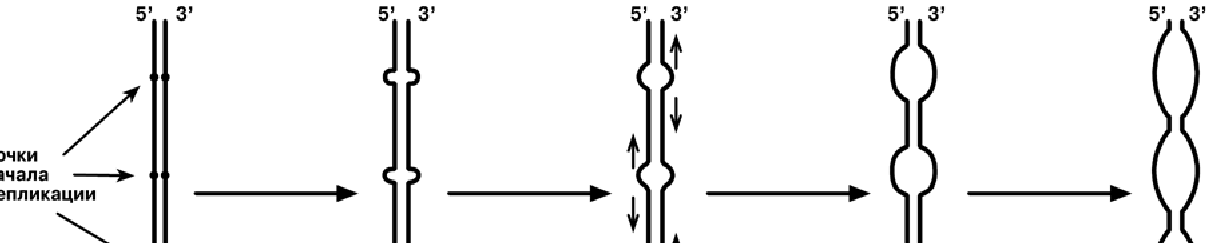
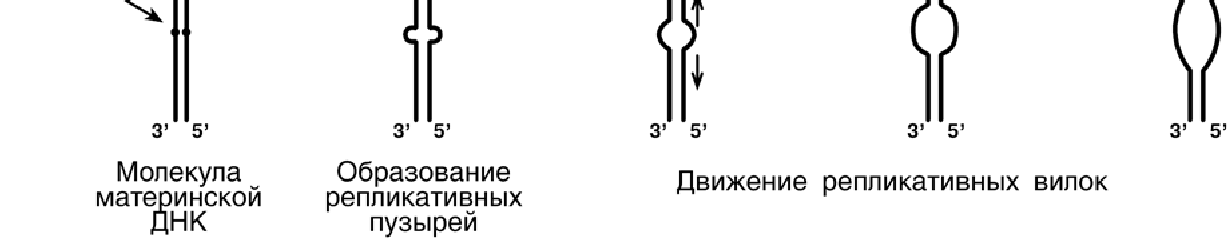
В каждой репликативной вилке идет синтез ДНК в направлении от 5'-конца к
3'-концу, т.е. 5'-конец новой ДНК остается свободным, следующие нуклеотиды при-
соединяются к 3'-гидроксильной группе предыдущего нуклеотида. Поскольку нити
ДНК антипараллельны, то непрерывно синтезируется только одна нить, а именно та,
на которой направление движения репликативной вилки совпадает с направлением
3' → 5'.
5
По мере расплетания и движения репликативной вилки на нити открываются
участки, где возможен синтез новой нити в направлении 5' → 3'.
Направление 5' → 3' другой материнской нити ДНК совпадает с направлением
движения репликативной вилки. Поэтому синтез дочерней нити (в направлении
5' → 3') возможен только после расплетания части ДНК и освобождения участка для
синтеза.
Таким образом, синтез дочерней ДНК на одной из нитей материнской ДНК идет
фрагментарно. По имени японского исследователя синтезируемые на отстающей
цепи отрезки ДНК назвали фрагменты Оказаки.
6
В целом для синтеза ДНК необходим ряд ферментов.
Ферменты репликации эукариот и их функция
В И Д А К Т И В Н О С Т И Ф У Н К Ц И Я
Топоизомеразы -Эндонуклеазная-Разрезание молекулы ДНК для облегчения ее расплетания и раскручивания
Хеликазы -Эндонуклеазная-Раскручивание молекулы ДНК
ДНК-связывающие белки- Стабилизация расплетенных нитейДНК
ДНК-полимераза α -5'-3'–Полимеразная -Синтез РНК-затравки на основе молекулы ДНК
ДНК-полимераза β-5'-3'–Полимеразная3'-5'–Экзонуклеазная5'-3'–Экзонуклеазная
Репарация повреждений.
ДНК-полимераза ε -5'-3'–Полимеразная3'-5'–Экзонуклеазная-Элонгация отстающей цепи дочерней ДНК на матрице материнской ДНК
ДНК-полимераза δ-5'-3'–Полимеразная-3'-5'–ЭкзонуклеазнаяЭкзонуклеазная
Элонгация ведущей цепи дочернейДНК на матрице материнской ДНК
ДНК-лигаза Сшивка фрагментов Оказаки
4) Беззондовый метод определения кислотности
желудочного сока (ацидотест)
Принцип
Введенный в желудок per os краситель (2,4-диамино-4-
этоксиазобензол) освобождается из драже под действием
свободной соляной кислоты (pH3,0). Через 1,5 часа краситель
появляется в моче. При подкислении мочи кислотой (25% раствор
HСl) образуется солянокислая соль красителя красного цвета.
Сопоставление окраски с приложенной шкалой служит показателем
кислотности желудочного сока.
Проведение анализа
Подготовка пациента: после голодания в течение 8 часов и
опорожнения мочевого пузыря пациент принимает кофеинбензоат
натрия (в 100 мл воды), стимулирующего желудочную секрецию и
диурез.
Через 1 час собирают «контрольную» мочу. Пациент, не
разжевывая, проглатывает драже красителя и через 1,5 часа
собирает мочу.
Анализ проводят одновременно с обеими порциями мочи:
доводят водой до 200 мл, отбирают по 5 мл разбавленной мочи,
добавляют по 5 мл 25% HCl и сравнивают со шкалой.
Метод удобен, надежен, щадит больного, рекомендуется при
противопоказаниях к фракционному зондированию (гипертоническая
болезнь, невропатии).
Билет №4
1) Г Н И Е Н И Е Б Е Л К О В В К И Ш Е Ч Н И К Е
При ухудшении всасывания аминокислот, при избытке белковой пищи, при на-
рушении деятельности пищеварительных желез, недопереваренные остатки белков
достигают толстого кишечника, где подвергаются воздействию кишечной микрофло-
ры. Этот процесс получил название гниение белков в кишечнике. Он также акти-
вируется при снижении перистальтики кишечника (запоры). При этом образуются
продукты разложения аминокислот, представляющие собой как токсины (кадаве-
рин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин), так и ней-
ромедиаторы (серотонин, гистамин, октопамин. тирамин). При распаде серусодер-
жащих аминокислот образуются сероводород и метилмеркаптан (СН3SН).
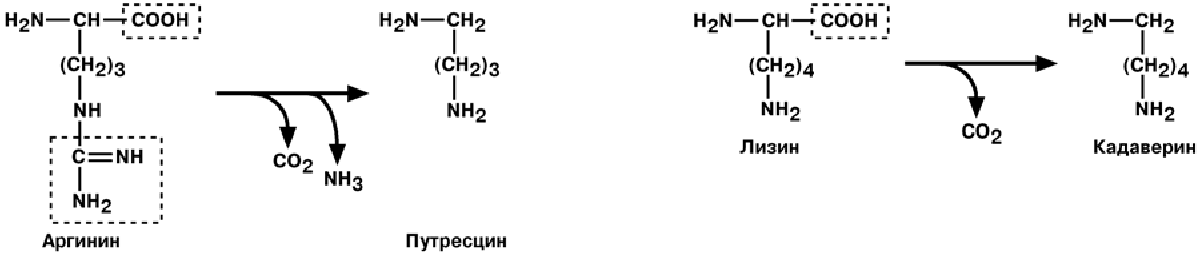
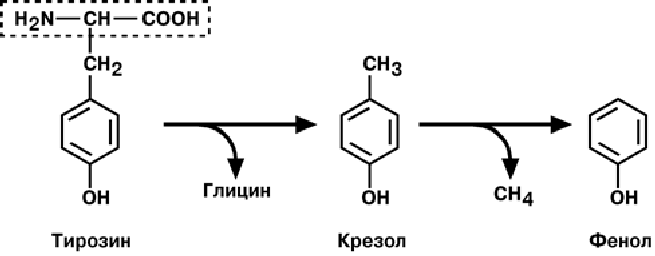
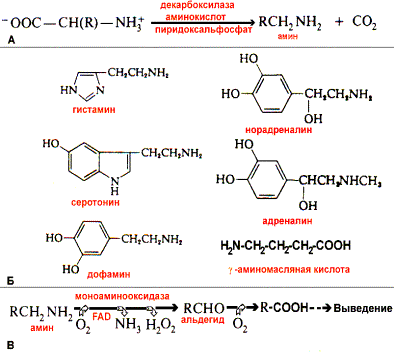
2) В результате отщепления -карбоксильной группы аминокислот образуются амины. Реакция катализируется декарбоксилазами, коферментом которых является фосфопиридоксаль. Продукты декарбоксилирования обладают высокой биологической активностью и с этим связано их название - биогенные амины. Приведем некоторые примеры.
|
Образование и обезвреживание биогенных аминов |
Гистамин образуется из гистидина в тучных клетках. Выделяется в ответ на присутствие аллергена. Кроме того, является сильным сосудорасширяющим фактором, вызывает сокращение гладкой мускулатуры, в клетках слизистой желудка стимулирует секрецию соляной кислоты.
-аминомасляная кислота (ГАМК) образуется из глутамата в ткани головного мозга, выполняет функции тормозного нейромедиатора.
Серотонин образуется из триптофана в нейронах гипоталамуса. Функционирует как возможный нейромедиатор возбуждающего характера.
Дофамин образуется из тирозина в почках, надпочечниках, синаптических ганглиях, нервах. Является медиатором ингибирующего типа, функционирует в черной субстанции верхнего отдела ствола мозга. В других клетках является предшественником норадреналина и адреналина.
Норадреналин образуется в результате гидроксилирования дофамина в клетках нервной ткани, мозговом веществе надпочечников. Функционирует как медиатор в синаптической передаче нервных импульсов.
Адреналин - продукт метилирования норадреналина в клетках мозгового вещества надпочечников. Выполняет функции гормона.
Инактивация биогенных аминов происходит путем их дезаминирования и окисления. Реакцию катализирует FAD-зависимая моноаминооксидаза (МАО). Моноаминооксидаза может быть точкой воздействия некоторых лекарств, ингибирующих или активирующих этот фермент, так как изменение концентрации биогенных аминов является причиной ряда патологических состояний. Например, при паркинсонизме наблюдается уменьшение количества дофамина, и одним из способов лечения является снижение скорости инактивации дофамина под влиянием веществ-ингибиторов МАО.
3) Т Р А Н С К Р И П Ц И Я
Транскрипция (англ. transcription – переписывание), – это биосинтез РНК на мат-
рице ДНК. Биосинтез РНК происходит в участке ДНК, который называется транс-
криптом, с одного края он ограничен промотором (начало), с другого – терминато-
ром (конец).
Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых
элементов:
• матрица – одна из цепей ДНК
• растущая цепь – РНК
• субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ)
• источник энергии – УТФ, ГТФ, ЦТФ, АТФ
• ферменты – РНК-полимеразы.
9
Существует три основных типа РНК-полимераз: для синтеза пре-рРНК (РНК-
полимераза I), для синтеза пре-мРНК (РНК-полимераза II), для синтеза пре-тРНК и
5S-рРНК (РНК-полимераза III).
В составе РНК-полимеразы E.coli выделяют четыре субъединицы: две
α-субъединицы, по одной β- и β’-субъединице. Имеется также дополнительный бел-
ковый σ-фактор Последний необходим только для связывания с промотором и не
участвует в удлинении цепи РНК.
Строение РНК-полимераз эукариот имеет много общего со структурой бактери-
ального фермента: они имеют по две больших субъединицы и несколько малых
субъединиц.
С Т А Д И И Т Р А Н К Р И П Ц И И
Инициация
Промотор содержит стартовый сигнал транкрипции ТАТА-бокс – определенную
последовательность нуклеотидов ДНК, присоединяющий инициирующий
ТАТА-фактор. Этот ТАТА-фактор обеспечивает присоединение РНК-полимеразы к
той нити ДНК, которая будет использоваться в качестве шаблона для транскрипции.
Так как промотор ассиметричен, то он связывает РНК-полимеразу только в одной
ориентации, что определяет направление транскрипции от 5’-конца к 3’-концу
(5’ → 3’).
Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой.
После синтеза затравочного фрагмента РНК длиной 8-10 рибонуклеотидов
σ-фактор отрывается от фермента.
Элонгация
Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы
вдоль ДНК и расплетание нитей ДНК на протяжении примерно 17 нуклеотидных пар.
РНК-полимераза продвигается со скоростью примерно 40-50 нуклеотидов в секунду
в направлении 5’ → 3’. Используя одновременно в качестве субстрата и источника
энергии АТФ, ГТФ, ЦТФ, УТФ.
Терминация
РНК-полимераза остановится, когда достигнет терминирующих кодонов. С по-
мощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ - "ро"),
от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая
является первичным транскриптом, предшественником мРНК или тРНК или рРНК
П Р О Ц Е С С И Н Г Р Н К .
Снтезированные молекулы РНК являются и в дальнейшем претерпевают ряд
изменений, которые называются процессингом. У эукариот процессингу подверга-
ются все виды пре-РНК, у прокариот – только предшественники рРНК и тРНК.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А М Р Н К
1. Кэпирование (англ. cap - шапка) – происходит еще во время транскрипции,
состоит в том, что к 5’-трифосфату концевого нуклеотида пре-мРНК присоединяется
5’-углерод N7-метил-гуанозина. «Кэп» необходим для защиты молекулы РНК от
5’-3’-экзонуклеаз.
2. При транскрипции
зон ДНК, несущих ин-
формацию о белках,
образуются гетероген-
ные ядерные РНК, по
размеру намного пре-
восходящие мРНК. Де-
ло в том, что из-за мо-
заичной структуры ге-
нов эти гетерогенные
РНК включают в себя
информативные (экзо-
ны) и неинформативные
(интроны) участки. При
особом процессе –
сплайсинге (англ.
splice – склеивать
встык) происходит уда-
ление интронов и со-
хранение экзонов.
11
3. Полиаденилирование – при помощи полиаденилат-полимеразы с использо-
ванием молекул АТФ происходит присоединение к 3’-концу 100-200 адениловых нук-
леотидов, формирующих поли (А)-хвост.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А Р Р Н К
Предшественники рРНК являются более крупными молекулами по сравнению со
зрелыми рРНК
У прокариот большая прерибосомная 30S-РНК расщепляется специфичными
нуклеазами с образованием 5S-рРНК, 16S-рРНК, и 23S-рРНК.
У эукариот большая прерибосомная 45S-РНК расщепляется специфичными
нуклеазами с образованием 5,8S-рРНК, 18S-рРНК, и 28S-рРНК.
П Р О Ц Е С С И Н Г П Р Е Д Ш Е С Т В Е Н Н И К А Т Р Н К
1. Формирование на 3’-конце последовательности Ц-Ц-А. Для этого у одних
пре-тРНК с 3’-конца удаляются лишние нуклеотиды до «обнажения» триплета Ц-Ц-А,
у других идет присоединение этой последовательности.
2. Формирование антикодоновой петли происходит путем сплайсинга и уда-
ления интрона в средней части пре-тРНК.
3. Модификация нуклеотидов путем дезаминирования, метилирования, вос-
становления. Например, образование псевдоуридина и дигидроуридина.
4) Количественное определение белка
микробиуретовым методом Ицаки-Гилла
Принцип
Белки и пептиды в щелочной среде образуют с медью
комплексное соединение (биуретовая реакция). Интенсивность
развивающегося фиолетового окрашивания пропорциональна
содержанию белка.
Реактивы
1) Биуретовый реактив: смесь сульфата меди (II) и натрия
гидроксида; 2) 0,9% раствор NaCl, 3) Эталонный раствор альбумина,
70 г/л.
Проведение анализа
ОПЫТ, мл СТАНДАРТ, мл
Сыворотка 0,04 -
Раствор альбумина - 0,04
Биуретовый реактив 3,0 3,0
Выдерживают 10 мин. Измеряют
оптическую плотность проб против воды
на ФЭКе при длине волны 540-560 нм.
Расчет
[Общий белок, г/л] = Еоп/ Ест*Сст
где ЕОП и ЕСТ – оптическая плотность опытной и стандартной
пробы, ССТ – концентрация белка в стандартной пробе.
Билет №5
1) О С Н О В Н Ы Е И С Т О Ч Н И К И А М М И А К А В О Р Г А Н И З М Е .
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее
активными его продуцентами в кровь являются органы с высоким обменом амино-
кислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными его источниками являются следующие реакции:
• неокислительное дезаминирование некоторых аминокислот (серина, треонина,
гистидина) – в печени;
• дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и поч-
ках;
• катаболизм биогенных аминов – во всех ткани, в наибольшей степени в нервной
ткани;
• жизнедеятельность бактерий
толстого кишечника
• распад пуриновых и пирими-
диновых оснований – во всех
тканях.
О Б Е З В Р Е Ж И В А Н И Е А М М И А К А
В тканях существуют несколько ме-
ханизмов обезвреживания аммиака:
• синтез глутаминовой кислоты –
происходит практически во всех
тканях, но имеет небольшое значе-
ние, т.к. для глутаматдегидрогена-
зы предпочтительным субстратом
является глутаминовая кислота и
равновесие реакции сдвинуто в
сторону α-кетоглутарата;
• синтез глутамина – главный спо-
соб уборки. Наиболее активно про-
исходит в нервной и мышечной
тканях, в почках, сетчатке глаза,
печени. Реакция протекает в мито-
хондриях;
• синтез аспарагина – является вто-
ростепенным способом уборки ам-
миака, энергетически невыгоден,
т.к. тратится 2 макроэргические
связи;
2) Нарушение обмена пуриновых оснований
Выделяют три основных нарушения обмена пуринов: подагра (хроническая ги-перурикемия), мочекаменная болезнь и синдром Леша-Нихана.
Подагра
Если образование мочевой кислоты в организме превышает ее выведение, то развивается состояние называемое гиперурикемия. Когда гиперурикемия принимает хронический характер, говорят о наличии подагры. В крови мочевая кислота нахо-дится в форме ее солей – уратов натрия. Растворимость уратов в плазме крови неве-лика и при превышении порога растворимости в плазме образуются кристаллы. Они откладываются в мягких тканях, суставах, образуя тофусы – подагрические узлы в мелких суставах, сухожилиях, хрящах, коже. Накапливающиеся в межклеточном ве-ществе ураты некоторое время фагоцитируются, однако, фагоциты не способны раз-рушить пуриновое кольцо. В конце концов, это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов и развитию острой воспалительной реакции – раз-вивается подагрический артрит. В 50-75% случаев первым признаком заболевания яв-ляется мучительная ночная боль в больших пальцах ног.
Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение за-болевших мужчин и женщин составляет 20 : 1.
Длительное время подагру считали «болезнью гурманов», однако в настоящее время внимание исследователей переместилось к изменению активности ферментов метаболизма пуринов:
• увеличение активности ФРПФ-синтетазы – приводит к избыточному синтезу пу-ринов
• уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы (ГГФРТФ) – из-за этого ФРПФ не используется в связывании азотистых оснований, а уходит в первую реакцию синтеза пуринов. В результате возрастает количе-ство разрушающихся пуринов и одновременно повышается их образование.
Оба этих нарушения рецессивны и сцеплены с X-хромосомой.
Лечение подагры сводится к снижению поступления предшественников мочевой кислоты с пищей и уменьшению ее образования в организме. Это подразумевает со-блюдение строжайшей диеты на протяжении весьма длительного времени, исключе-ния из рациона продуктов, содержащих много пуриновых оснований – кофе, чай, шо-колад, мясные продукты, печень, красное вино. К лекарственным средствам лечения подагры относят аллопуринол, по струк-туре схожий с гипоксантином. Ксанти-ноксидаза окисляет аллопуринол в аллок-сантин, а последний остается прочно свя-занным с ферментом и подавляет его ак-тивность. Происходит, образно говоря, самоубийственное ингибирование. Как след-ствие, ксантин не превращается в мочевую кислоту, а гипоксантин и ксантин лучше растворимы в воде, и они более легко выводятся из организма с мочой.
Кроме аллопуринола используют препараты, увеличивающие выведение моче-вой кислоты почками – антуран, цинхофен.
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании кристаллов (камней) в моче-выводящих путях. Вообще кристаллы могут иметь различную природу: 70-75% боль-ных мочекаменной болезнью имеют камни щавелевой кислоты (оксалаты), 15% – мо-чевой кислоты, 10% – кальций-фосфатные, карбонатные, цистиновые камни.
Примерно у половины больных подагрой в мочевыводящих путях откладывают-ся мочевые камни. Особенно они представлены в дистальных канальцах и собира-тельных трубочках. Причиной отложения кристаллов мочевой кислоты является ги-перурикемия и повышенное выведение уратов с мочой. Особенно возрастает количе-ство камней при закислении мочи в результате питания животной пищей, которая со-держит большое количество неорга-нических кислот и является «ки-слой». Дело в том, что при ней-тральных и щелочных значениях рН мочевая кислота находятся в форме уратов (енольная форма), а при сни-жении рН до 5,75 переходят в кето-форму мочевой кислоты, которая в 17 раз хуже растворима по сравнению с ее солями. Учитывая, что даже нормальная рН мочи лежит в диапазоне 5,3-6,5 легко представить, сколько мочевой кислоты спо-собно кристаллизоваться в почечных канальцах.
Лечение заболевания, как при подагре сводится к ограничению поступления пу-риновых оснований и предовращению образования мочевой кислоты. В дополнение рекомендуется растительная диета, приводящая к защелачиванию мочи, что увеличи-вает долю более растворимых в воде уратов.
Cиндром Леша-Нихана
Болезнь Леша-Нихана – это полное врожденное отсутствие активности гипок-сантин-гуанин-фосфорибозил-трансферазы, фермента отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в США студент-медик Майкл Леш и педиатр Уильям Нихан в 1964 г.
Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживают-ся отклонения в развитии, а именно отставание физического развития (с трудом дер-жит голову), повышенная возбудимость, рвота, периодическое повышение тмперату-ры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окра-ске пеленок. К концу первого года жизни симптомы драматически нарастают, разви-вается нарушение координации движений, хореоатеоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни – аутоагрессия, самокалечение – неодолимое стремление детей кусать себе гу-бы, язык, суставы пальцев на руках и ногах
3)Серин и глицин превращаются друг в друга
Роль реакции превращения серина в глицин состоит в образовании активной формы тетрагидрофолиевой кислоты – N5,N10-метилен-ТГФК.