
- •1)Азотистый баланс
- •1. Синтез 5'-фосфорибозиламина
- •Реакции синтеза амф и гмф
- •4. Образование нуклеозидтрифосфатов атф и гтф.
- •1) Главные компоненты желудочного сока
- •Реакция взаимопревращения глицина и серина
- •2) Распад пуриновых оснований
- •3) Регуляция синтеза белка
- •4) Обнаружение молочной кислоты в желудочном
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •Механизм реакции синтеза дезоксирибонуклеотида
- •3. Реакция фосфорилирования
- •4) Определение свободной соляной кислоты
- •Окисление аланина
- •3) Синтез амидов из карбоновых кислот
- •1. Особенности обмена метионина
- •2. Обмен цистеина
- •4) Мочевая кислота сыворотки крови
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Переваривание белков в желудочно-кишечном тракте
Реакции синтеза амф и гмф
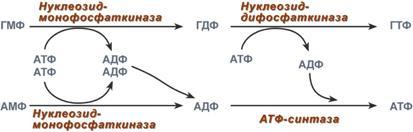
4. Образование нуклеозидтрифосфатов атф и гтф.
Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза, образующий АТФ в реакциях окислительного фосфорилирования.
3) Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи.
Под вторичной структурой нуклеиновых кислот понимают пространственно упорядоченные формы полинуклеотидных цепей.
Рибонуклеиновая кислота (РНК) представляет собой последовательность рибонуклеозидмонофосфатов, связанных друг с другом 5’-3’-фосфодиэфирными
связями. РНК отличается от ДНК однонитевой структурой, наличием урацила вместо тимина и рибозы вместо дезоксирибозы.
В клетке присутствует четыре типа РНК:
Рибосомальные РНК (рРНК) у прокариот и эукариот различны и отличаются ве-
личиной седиментации (S, величиной скорости оседания молекулы). У прокариот три разновидности рРНК: 5S, 16S и 23S. У эукариот четыре разновидности: 5S, 5,8S, 18S и 28S. Рибосомальные РНК участвуют в построении рибосом, внутриклеточных белоксинтезирующих органелл.
Рибосомы состоят из двух неравных субчастиц, малой и большой.
У прокариот
• малую (30S) субчастицу образуют белки, 23S-рРНК и 5S-рРНК;
• большую (50S) – белки и 16S-рРНК.
У эукариот
• малую (40S) субчастицу образуют белки и 18S-рРНК,
• большую (60S) – белки и 5S-, 5,8S-, 28S-рРНК.
Матричные РНК (мРНК) представляют собой линейную последовательность
нуклеотидов. К 5’-концу молекулы присоединен метилгунозиндифосфат, на 3’-конце имеется полиадениловая последовательность. Их функция – информационная, т.е. перенос информации о структуре белков от ДНК к месту
их синтеза.
Транспортные РНК (тРНК) бактерий и эукариот включают 73-93 нуклеотида. Они переносят аминокислоты из цитозоля к рибосомам.Вторичная структура тРНК напоминает клеверный лист, а третичная – латинскую букву L.
В «клеверном листе» выделяют четыре участка (или ветви, петли), каждый из которых имеет собственную функцию: антикодоновый,псевдоуридиловый, дигидроуридиловый, акцепторный. На 5’-конце тРНК находится гуаниловый нуклеотид, на 3’-конце – триплет Ц-Ц-А.
• • Малые РНК – используются для созревания мРНК и некоторых других клеточных процессов
4) Принцип: В рез-те трансаминирования происх. Под действием АсАТ и АлАТ, обр-я оксалоацитат и пируват. Оксалоацетат, подвергаясь декарбоксилированию, превращ в пируват. При добавлении кислого 2,4-динитрофенилшидразина проц.останавливается и получается гидразон пировиногр.к-ты. Последний в щелочной среде дает окрашивание интенсивность кот пропорциональна кол-ву образовавш. Пировиноградной к-ты
Ход: 3 пробирки. В 1 и 2-субтрат д/определ. АлАт, в 3-для АсАТ. В первую-станд.р-р. Во 2 и 3-сыворотку. Перемешивают и инкубируют 30 мин при Т37. Чз пол часа в 3 пробирки вносят реактив динитрофенилгидразина. Перемешивают и оставл.при комн.Т на 10 мин. Затем в 3 проб-р-р едкой щелочи. Перемешивают и колориметрируют чз 10 мин при длине волны 505.
Клинико-диагн.знач: использ.д/выявления патологич процессов миокарда(при инфаркте значит увеличив АсАт) и печени(при цмрозе, гепатите повышается активность АлАТ)
Билет №2
1) Белки, поступающие с пищей, подвергаются в желудочно-кишечном тракте распаду при участии протеолитических ферментов или пептидгидролаз, которые ускоряют гидролитическое расщепление пептидных связей между аминокислотами. Различные пептидгидролазы обладают относительной специфичностью, они способны катализировать расщепление пептидных связей между определенными аминокислотами. Пептидгидролазы выделяются в неактивной форме ( это предохраняет стенки пищеварительной системы от самопереваривания). Активируются они при поступлении пищи в соответствующий отдел желудочно-кишечного тракта или при виде и запахе пищи по механизму условного рефлекса. Активация пепсина и трипсина происходит по механизму автокатализа, другие пептидгидролазы активируются трипсином.
Во рту белки пищи только механически измельчаются, но не подвергаются химическим изменениям, так как в слюне нет пептидгидролаз. Химическое изменение белков начинается в желудке при участии пепсина и соляной кислоты. Под действием соляной кислоты белки набухают, и фермент получает доступ во внутренние зоны их молекул. Пепсин ускоряет гидролиз внутренних (расположенных далеко от концов молекул) пептидных связей. В результате из белковой молекулы образуются высокомолекулярные пептиды. Если в желудок поступают сложные белки, пепсин и соляная кислота способны катализировать отделение их простетической (небелковой) группы.
Высокомолекулярные пептиды в кишечнике подвергаются дальнейшим превращениям в слабощелочной среде под действием трипсина, химотрипсина и пептидаз. Трипсин ускоряет гидролиз пептидных связей, в образовании которых принимают участие карбоксильные группы аргинина и лизина; химотрипсин расщепляет пептидные связи, образованные с участием карбоксильных групп триптофана, тирозина и фенилаланина. В результате действия этих ферментов высокомолекулярные пептиды превращаются в низкомолекулярные и некоторое количество свободных аминокислот. Низкомолекулярные пептиды в тонком кишечнике подвергаются действию карбоксипептидаз А и В, отщепляющих концевые аминокислоты со стороны свободной аминогруппы, и аминопептидаз, делающих то же самое со стороны свободной аминогруппы. В результате образуются дипептиды, которые гидролизуются до свободных аминокислот под действием дипептидаз. Аминокислоты и некоторое количество низкомолекулярных пептидов всасываются кишечными ворсинками. Этот процесс требует затрат энергии. Часть аминокислот уже в стенках кишечника включаются в синтез специфических белков, большая же часть продуктов пищеварения поступает в кровь (95%) и в лимфу.
Часть аминокислот, образовавшаяся в процессе пищеварения, и непереваренные белки нижних отделов кишечника подвергаются гниению под действием кишечных бактерий. Из некоторых аминокислот образуются ядовитые продукты: фенолы, амины, меркаптаны. Они частично выводятся из организма с калом, частично всасываются в кровь, переносятся ею в печень, где происходит их обезвреживание. Этот процесс требует значительных затрат энергии.
Сложный белок в пищеварительной системе распадается на белок и простетическую группу. Простые белки подвергаются гидролизу до аминокислот. Превращения простетических групп происходят в соответствии с их химической природой. Гем хромопротеидов окисляется в гематин, который почти не всасывается в кровь, а выделяется с калом. Нуклеиновые кислоты в кишечнике гидролизуются при участии эндонуклеаз, экзонуклеаз и нуклеотидаз. Под действием эндонуклеаз из молекул нуклеиновых кислот образуются крупные осколки - олигонуклеотиды. Экзонуклеазы от концов молекул нуклеиновых кислот и олигонуклеотидов отщепляют мономеры - отдельные мононуклеотиды, которые под действием нуклеотидаз могут распадаться на фосфорную кислоту и нуклеозид. Мононуклеотиды и нуклеозиды всасываются в кровь и переносятся к тканям., где мононуклеотиды используются для синтеза специфических нуклеиновых кислот, а нуклеозиды подвергаются дальнейшему распаду
2)
О К И С Л И Т Е Л Ь Н О Е Д Е З А М И Н И Р О В А Н И Е
Выделяют два варианта окислительного дезаминирования:
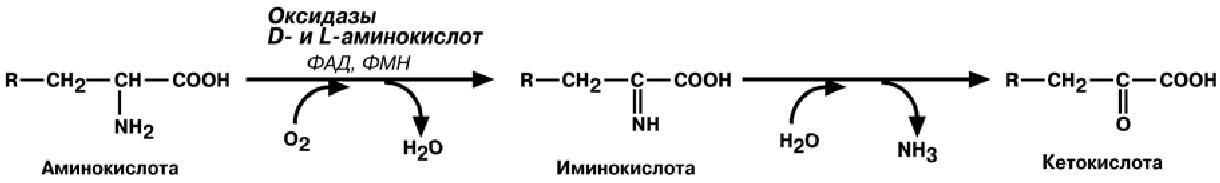
1. Прямое окислительное дезаминирование – катализируется оксидазами
D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксида-
зами L-аминокислот (L-оксидазы) с коферментом ФМН. Прямое дезаминирование
катализируется одним ферментом, в результате образуется NH3 и кетокислота.
2. Непрямое окислительное дезаминирование, включает 2 этапа и активно идет
во всех клетках организма. Первый этап заключается в переносе NH2-группы с ами-
нокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты
и называется трансаминирование. Второй этап состоит в отщеплении аминогруппы
от новообразованной аминокислоты – дезаминирование.
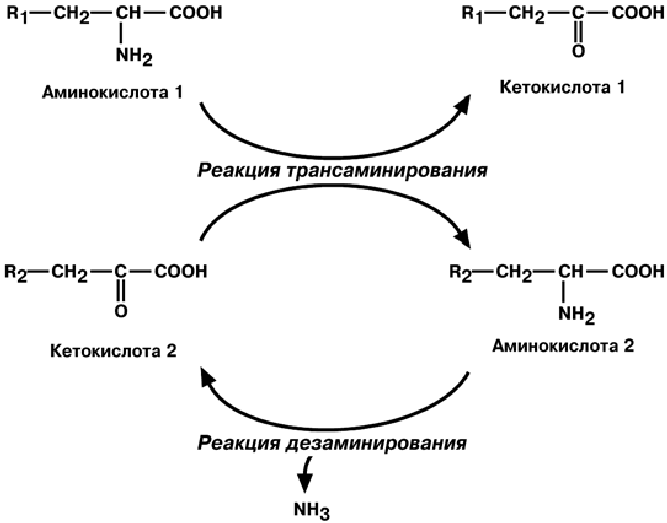
Учитывая тесную связь обеих реакций непрямого окислительного дезаминирова-
ния, его называют также трансдезаминирование и обобщенно изображают схемой
В качестве кетокислоты-акцептора ("кетокислота 2") в организме в основном ис-
пользуется α-кетоглутаровая кислота, она превращается в глутамат и транспортиру-
ет аминогруппу в гепатоциты. Образованные кетоаналоги аминокислот остаются в
клетке и используются как источник энергии.
Роль трансдезаминирования
• Сопряженные реакции трансаминирования и дезаминирования создают поток
лишнего азота из периферических клеток в печень.
• Реакции трансаминирования обеспечивают синтез аминокислот при наличии их
углеродного скелета (кетоаналога).
• Обратимость процессов позволяет клетке использовать при необходимости сво-
бодный аммиак.
Ниже подробно разбираются реакции трансаминирования и дезаминирования.
Трансаминирование.
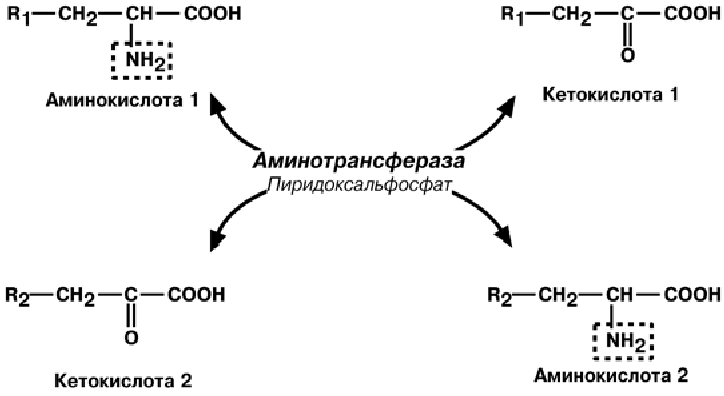
Сначала происходит обратимая реакция – перенос NH2-группы с аминокислоты
на другую кетокислоту (трансаминирование). Последняя при этом превращается в
аминокислоту.
15
Механизм реакции трансаминирования достаточно сложен и протекает по прин-
ципу пинг-понг. Аминотрансферазы являются сложными ферментами, в качестве
кофермента они имеют пиридоксальфосфат (активная форма витамина В6). Сна-
чала к нему присоединяется аминокислота, превращается в кетокислоту и отделяет-
ся. Аминогруппа при этом переходит на кофермент и образуется пиридоксамин-
фосфат. После этого присоединяется другая кетокислота, получает аминогруппу,
образуется новая аминокислота и регенерирует пиридоксальфосфат.
Роль пиридоксальфосфата сводится к образованию промежуточных соедине-
ний – шиффовых оснований (альдимин, кетимин).
Трансаминирование активируется:
• при поступлении в клетку избыточного количества аминокислот;
• при прекращении использования аминокислот на синтез азотсодержащих соеди-
нений: белков, креатина, фосфолипидов, пуриновых и пиримидиновых основа-
ний;
• при гипогликемиях различного генеза, сахарном диабете, т.е. при внутриклеточ-
ном голодании.
В результате аминокислоты теряют NH2-группы и превращаются в соответст-
вующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями
и вовлекается в цикл трикарбоновых кислот, где сгорает до СО2 и Н2О.
Чаще всего аминоислоты взаимодействуют со следующими кетокислотами: пировиноградной (с образованием аланина), щавелево-
уксусной (с образованием аспартата),α-кетоглутаровой (собразованием глутамата). Однако аланин и аспартат в дальнейшем
передают свою аминогруппу нα-кетоглутаровую кислоту.
Таким образом, втканях осуществляется поток избыточных аминогрупп на один акцептор α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
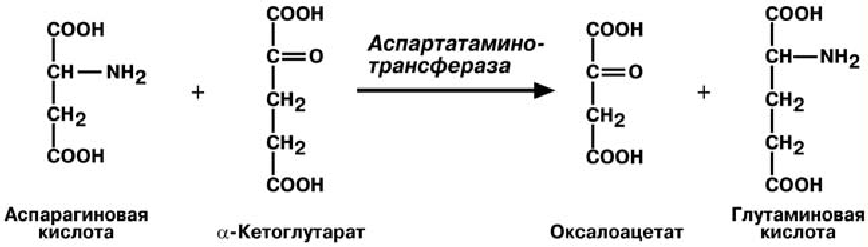
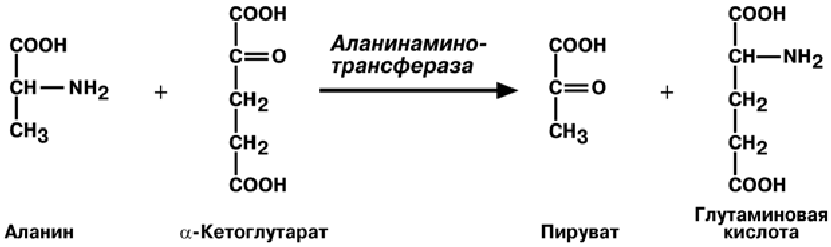
В медицине нашло практическое применение определение активности двух ами-
нотрансфераз – аланинаминотрансферазы(АЛТ) и аспартатаминтрансферазы (АСТ).
Определение активности АЛТ и АСТимеет исключительное значение для диагностики и дифференциальной диагностики болезней печени и миокарда и контроля эффективности лечения.
Дезаминирование
Так как в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается дезаминированию с образованием
аммиака и α-кетоглутаровой кислоты. При дефиците энергии реакция способна происходить в митохондриях любых клеток организма, так как α-кетоглутарат при этом
вовлекается в реакции ЦТК.Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая удаляется с мочой.
3) Последовательность химических реакций синтеза пиримидиновых нук-леотидов, в частности УМФ, можно представить в следующем виде:
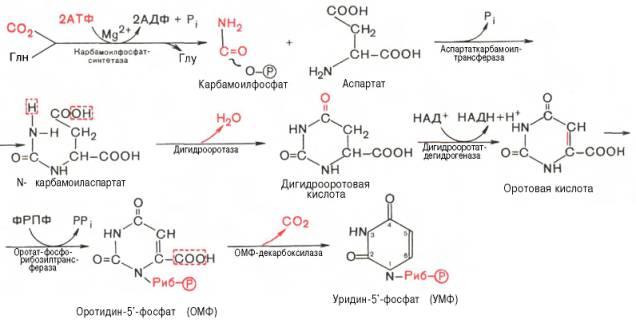
Как видно, I стадия синтеза УМФ включает катализируемое цито-плазматической карбамоилфосфатсинтетазой образование карбамоилфос-фата из глутамина (см. главу 12).
На II стадии карбамоилфосфат реагирует с аспартатом, в результате чего образуется N-карбамоиласпарагиновая кислота. Последняя подвергается циклизации (под действием дигидрооротазы) с отщеплением молекулы воды, при этом образуется дигидрооротовая кислота, которая, подвергаясь дегидрированию, превращается в оротовую кислоту. В этой реакции участвует специфический НАД-содержащий фермент дигидро-оротатдегидрогеназа. Оротовая кислота обратимо реагирует с ФРПФ, являющимся донатором рибозо-фосфата, с образованием оротидин-5'-фос-фата (ОМФ). Декарбоксилирование последнего приводит к образованию первого пиримидинового нуклеотида – уридин-5-фосфата (УМФ).
Превращение УМФ в УДФ и УТФ осуществляется, как и пуриновых нуклеотидов, путем фосфотрансферазных реакций:
УМФ + АТФ <=> УДФ + АДФ ;
УДФ + АТФ <=> УТФ + АДФ.
4)
Принцип:креатин в щел.ср. дает с пикрин.кислотой пикрат кератина оранж-крас цвета. Интенсивность овраски пропорциональна концентр.креатина в моче
Ход работы: в 2 пробирки: 1-вносят мочу, разведен в 50 раз, во2-эталон.р-р кератина. В каждую пробирку по 0,5 пикриновой к-ты, по 0,5 NaOH. Перемешивают и чз 30 мин колориметрируют.
Нормальные величины:
Д:27-62 мкмоль/л
Ж:44-88 мкмоль/л, М: 44-100 мкмоль/л
Билет №3
