
- •Корпускулярно-волновой дуализм микрообъектов
- •Элементы квантовой механики
- •Квантовая теория свободных электронов в металле
- •Введение в теорию твердых тел
- •Основы физики лазеров
- •Элементы физики ядра и элементарных частиц
- •§ 1. Краткие исторические сведения
- •§ 2. Тепловое излучение
- •§ 3. Излучение абсолютно черного тела. Закон Кирхгофа.
- •Итоги лекции n 1
- •Лекция n 2 Проблема излучения абсолютно черного тела. Формула Планка. Закон Стефана-Больцмана, закон Вина § 1. Проблема излучения абсолютно черного тела. Формула Планка
- •§ 2. Закон Стефана-Больцмана и закон Вина
- •Итоги лекции n 2
- •Лекция n 3 Проблема фотоэффекта. Уравнение Эйнштейна для фотоэффекта § 1. Проблема фотоэффекта
- •§ 2. Уравнение Эйнштейна для фотоэффекта
- •Итоги лекции n 3
- •Лекция n 4 Боровская теория атома водорода Спектр излучения атома водорода в теории Бора § 1. Боровская теория атома водорода
- •Первый постулат Бора:
- •Второй постулат Бора:
- •§ 2. Спектры излучения атома водорода в теории Бора
- •Итоги лекции n 4
- •Корпускулярно-волновой дуализм микрообъектов
- •Лекция n 5 Свойства фотонов. Вероятностная интерпретация плотности энергии и интенсивности электромагнитной волны
- •§ 1. Свойства фотонов
- •2. Масса фотона
- •3. Энергия фотона
- •§ 2. Неделимость фотона
- •§ 3. Интерференция одиночных фотонов
- •§ 4. Вероятностная интерпретация плотности энергии и интенсивности электромагнитной волны
- •Итоги лекции n 5
- •§ 1. Гипотеза де Бройля. Волновые свойства электронов
- •Лекция n 6 § 2. Дифракция одиночных электронов
- •§ 3. Волновая функция и волна де Бройля
- •§ 4. Соотношения неопределенностей
- •Итоги лекции n 6
- •§ 2. Понятия об операторах физических величин
- •§ 3. Решение уравнения Шредингера для простейших случаев: свободная частица и частица в бесконечно глубокой одномерной потенциальной яме
- •§ 2. Квантовые числа
- •§ 3. Спектры атома водорода в теории Шредингера
- •§ 4. Волновая функция основного состояния атома водорода
- •Итоги лекции n 8
- •§ 2. Физические основы периодической системы элементов д. И. Менделеева
- •§ 3. Молекула
- •§ 4. Объяснение температурной зависимости теплоемкостей газов
- •Итоги лекции n 9
- •§ 1. Электронный газ в модели одномерной бесконечно глубокой ямы
- •§ 2. Электронный газ в модели бесконечно глубокой трехмерной потенциальной ямы
- •Итоги лекции n 10
- •Элементы квантовой статистики
- •Лекция n 11
- •§2. Анализ функции f(e)
- •Итоги лекции n 11
- •Лекция n 12 Результаты квантовой теории электропроводности. Термоэлектронная эмиссия. Бозоны. Распределение Бозе-Эйнштейна § 1. Результаты квантовой теории электропроводности металла
- •§ 2. Термоэлектронная эмиссия
- •§ 3. Бозоны. Распределение Бозе-Эйнштейна
- •Итоги лекции n 12
- •§ 2. Диэлектрики и полупроводники
- •§ 3. Собственная проводимость полупроводников
- •§ 2. Акцепторные примеси. Полупроводники p-типа
- •§ 3. Электронно-дырочный переход. Полупроводниковый диод
- •§ 4. Полупроводниковый триод - транзистор
- •Основы физики лазеров лекция n 15
- •§ 1. Вводные сведения
- •§ 2. Вынужденное (стимулированное) излучение
- •§ 3. Состояние с инверсией населенности
- •§ 4. Оптический резонатор
- •§ 5. Способы создания инверсии населенности
- •§ 6. Виды лазеров и их применение
- •§ 2. Дефект массы и энергия связи атомного ядра. Ядерные силы
- •§ 1. Некоторые сведения из истории открытия деления ядра урана
- •§ 2. Цепная ядерная реакция. Ядерная бомба
- •§ 3. Ядерный реактор
- •§ 4. Реакция синтеза атомных ядер. Проблема управляемых термоядерных реакций
- •Итоги лекции n 17
- •§ 1. Радиоактивность. Историческое введение
- •§ 2. Закон радиоактивного распада
- •§ 3. Взаимодействие радиоактивного излучения с веществом
- •§ 4. Методы регистрации ионизирующих излучений
- •Итоги лекции n 18
§ 2. Спектры излучения атома водорода в теории Бора
Изобразим на рис. 4.2. в масштабе энергетические уровни атома водорода En в зависимости от главного квантового числа n, в соответствии с формулой (4.10).
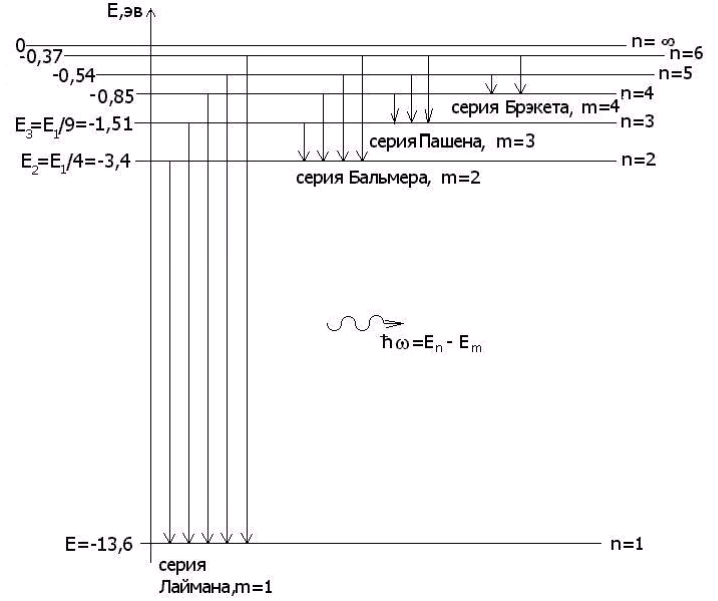
Рис. 4.2
Согласно
второму постулату Бора (4.4.) энергия
излученного фотона,
![]() ,
равна разности энергий стационарных
состояний, между которыми происходит
квантовый переход:
,
равна разности энергий стационарных
состояний, между которыми происходит
квантовый переход:
![]() ,
в случае излучения
n > m.
,
в случае излучения
n > m.
Подставляя сюда выражения для En и Em, (4.8) для частоты n, получим:

здесь

- постоянная Ридберга, она так названа в честь шведского физика И. Ридберга.
Так как λ = c/v, то для длины волны λ получим следующее выражение:
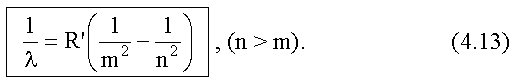
Здесь
![]()
- тоже называют постоянной Ридберга.
Из теории Бора следует, что спектр атома водорода имеет линейчатый характер, причем, наблюдаемые линии объединены в спектральные серии. Задается серия номером m уровня, на который происходит квантовый переход. Первые серии названы именами ученых-физиков:

Спектры атома водорода были изучены экспериментально до создания Бором своей теории. Хорошее совпадение экспериментальных данных с выводами теории Бора для спектров атома водорода говорит в пользу этой теории.
Однако, попытки применить теорию Бора к более сложным атомам потерпели неудачу. В настоящее время теория атома Бора представляет исторический интерес как промежуточный этап к созданию более верной теории. Такая теория теперь существует - это квантовая механика.
Итоги лекции n 4
-
Уравнение движения электрона в планетарной модели атома, записанное на основе второго закона Ньютона, позволяет атому иметь любой размер, опыт же показывает, что размеры атомов порядка 10-10 м. Это противоречие теории и опыта получило название проблемы размера атома.
-
Проблема стабильности атома состояла в том, что в планетарной модели атома электрон, двигаясь по окружности, должен, из-за наличия ускорения, непрерывно излучать энергию и через время ~10-8 с упасть на ядро. Однако, весь наш опыт весомо свидетельствует о стабильности атомов.
-
Проблемы эти были решены в 1913 г. Н. Бором на основе его двух постулатов:
1) существуют стационарные состояния атом, находясь в которых он не излучает электромагнитных волн. Условие стационарности состояния атома - квантование момента импульса электрона L:

2)
излучение испускается или поглощается
в виде квантов энергии
![]() при
переходе электрона из одного стационарного
состояния в другое. Энергия кванта равна
разности энергий стационарных
состояний атома, между которыми происходит
переход:
при
переходе электрона из одного стационарного
состояния в другое. Энергия кванта равна
разности энергий стационарных
состояний атома, между которыми происходит
переход:
![]()
здесь Еn - энергия стационарного состояния до перехода, Еm - энергия стационарного состояния после перехода.
-
Дополнив механику Ньютона этими постулатами, Н. Бор получил выражения для радиусов стационарных орбит rn (см. (4.5)):
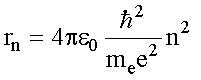
и энергии стационарных состояний атома водорода Еn (см. (4.8)):

В этих формулах n - целое положительное число: n = 1, 2, 3...
-
Из второго постулата Бора и формулы для Еn следует выражение, определяющее длины волн, излучаемых (и поглощаемых) атомом водорода (см. (4.12), (4.13)):

R' называют постоянной Ридберга, ее экспериментальное значение
![]()
Величину R также называют постоянной Ридбера, теория Бора дает для нее следующее выражение:

Теоретическое значение R близко к ее экспериментальному значению.
R = 3,29 · 1015 1/c.
