
- •Теоретия горения и взрыва анахов сергей вадимович
- •1. Введение.
- •Тема 2. Физические основы горения.
- •2.1. Свойства газов.
- •2.2. Свойства газовых смесей.
- •3. Парциальные давление и объем.
- •2.3. Свойства жидкостей.
- •2.4. Свойства сжиженных газов.
- •2.5. Свойства твердых веществ.
- •Тема 3. Химические основы горения.
- •3.1. Химизм реакций горения.
- •3.2.Теплосодержание веществ.
- •3.3. Тепловой эффект реакции.
- •3.4. Кинетические основы газовых реакций.
- •3.5. Энергия активации реакции.
- •3.6. Катализ.
- •3.7. Адсорбция.
- •Тема 4. Виды горения.
- •4.1. Горение газообразных, жидких и твердых веществ.
- •4.2. Гомогенное и гетерогенное горение.
- •4.3. Диффузионное и кинетическое горение.
- •4.4. Нормальное горение.
- •4.5. Дефлаграционное (взрывное) горение.
- •4.6. Детонационное горение.
- •Тема 5. Показатели пожаровзрывоопасности веществ.
- •5.1. Общие показатели для горючих веществ и видов горения.
- •5.2. Показатели взрывопожароопасности газо-, паро- и пылевоздушных смесей.
- •5.3. Показатели пожароопасности твердых компактных и пыле- видных веществ.
- •Тема 6. Возникновение горения.
- •6.1. Тепловое самовоспламенение (тепловой взрыв).
- •6.2. Самовозгорание.
- •6.3. Цепное самовоспламенение (цепной взрыв).
- •6.4. Зажигание.
- •Тема 7. Распространение пламени.
- •7.1. Тепловая теория горения.
- •7.2. Горение в замкнутом объеме.
- •7.3. Движение газов при горении.
- •7.5. Условия возникновения взрыва.
- •Тема 8. Ударные волны и детонация.
- •8.1. Ударные волны в инертном газе.
- •8.2. Воспламенение при быстром сжатии.
- •8.3. Возникновение детонации.
- •8.4. Стационарный режим распространения детонации.
- •8.5. Определение скорости детонации.
- •8.6. Вырождение детонации.
- •Тема 9. Погасание пламени (прекращение горения).
- •9.1. Концентрационные пределы распространения пламени.
- •9.2.Общие закономерности для пределов распространения пламени.
- •9.3. Затухание пламени в узких каналах.
- •9.5. Закономерности для точки флегматизации.
- •9.6. Механизм флегматизации взрывоопасных смесей.
- •Особенности физического взрыва
- •Энергетический потенциал
- •За что держится пламя?
3.4. Кинетические основы газовых реакций.
Закон действующих масс: скорость реакции при постоянной температуре пропорциональна концентрации реагирующих веществ («действующих масс»).
Скорость химической реакции (υ) - количество вещества, реагирующего в единицу времени (d) в единице объема (dV).
Рассмотрим реакцию, протекающую по уравнению:
А + В = С + Д.
![]() ,
(3.1)
,
(3.1)
Т = const:
![]() ,
(3.2)
,
(3.2)
где: k – константа скорости химической реакции.
аА + bB = cC + dД
![]() …
(3.3)
…
(3.3)
a, b, c, d - порядки реакции по компонентам А, В, С, Д, сумма показателей – общий порядок реакции.
А bB + cC – I порядка,
2А = bB + cC – II порядка,
А + B = cC + dД – III порядка.
Кинетическое уравнение I порядка типа
А=bB+cC…,
![]() .
(3.4)
.
(3.4)
[A0] - концентрацию компонента А до начала реакции:
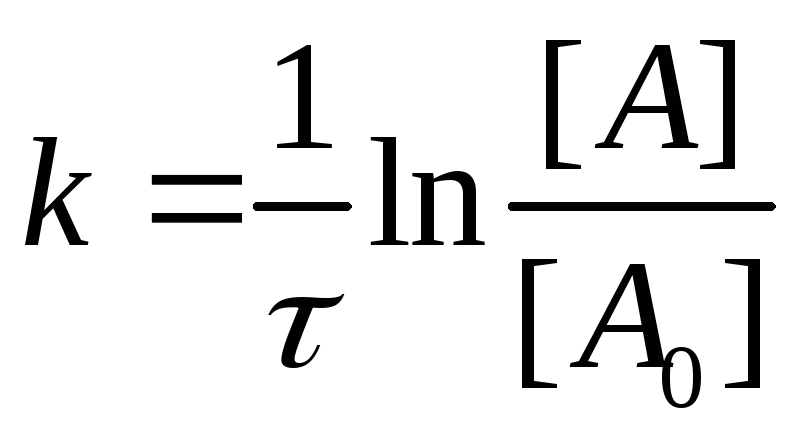 ,
или [A]=[A0]e-kt.
(3.5)
,
или [A]=[A0]e-kt.
(3.5)
Скорость химической реакции зависит не от количества столкновений всех молекул, а только активированных.
По закону Больцмана, число активных молекул
nA = nо * e-E/RT, (3.6)
где: Е – энергия активации,
Т – температура газовой смеси,
nо – общее число молекул.
Тогда и число эффективных соударений, совпадающее со скоростью реакции, равно:
υр = Zэфф = Z0 * e-E/RT, (3.7)
где: Z0 – общее число соударений молекул.
1) скорость реакции пропорциональна концентрации активных молекул, число которых зависит от температуры и давления в смеси, так как давление и есть количество молекул, сталкивающихся с какой-либо поверхностью;
-
реакция возможна лишь в том случае, если взаимодействующие молекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором возможно химическое превращение.
Минимальное количество тепловой энергии, необходимое для «запуска» химической реакции, называется энергией активации.
3.5. Энергия активации реакции.

Рис. 9. Схема активирования реакции.
Рассмотрим две реакции:
-
Н2+О2=Н2О-

-
Н2О=Н2+О2+

Как
видно из рисунка, Е2=![]() +Е1;
+Е1;
![]() =Е2
- Е1;
=Е2
- Е1;
![]() =Е1.
=Е1.
В общем, при любой реакции
![]() .
.
Энергия активации – это энергия, необходимая для превращения реагирующих веществ в состояние активного комплекса (разрыв межатомных связей, сближение молекул, накопление энергии в молекуле…).

(υр)
Р
υ1
υ2
3.6. Катализ.
Катализаторы - вещества, которые вводятся в реагирующую смесь, но не расходуются при реакции, а ускоряют ее путем снижения энергии активации.
Процесс увеличения скорости реакции с помощью катализаторов называется катализом.
Реакция без катализатора: А + В = АВ.
С катализатором Х: А + Х = АХ АХ + В = АВ + Х.

Рис. 11. Схема действия катализатора: Еб.кат и Ес кат – энергии активации реакции без катализатора и с катализатором соответственно.
