
- •Раздел 1.Строение вещества
- •Тема 1. 1. Строение атома. Псхэ.
- •1. Атом
- •2. Строение атома
- •2, 8,18, 32 - Максимальное количество электронов в соответствующих электронных слоях,
- •3. Периодическая система химических элементов (псхэ)
- •4. Валентность и степень окисления
- •5. Химическая связь(ковалентная и ионная)
- •6. Химические реакции
- •7. Скорость химической реакции
- •8. Обратимые реакции
- •8. Классификация неорганических соединений Вещества
- •9. Неметаллы
- •10. Металлы
- •11. Оксиды
- •Химические свойства
- •12. Гидроксиды
- •13. Соли
- •14. Кислоты
- •15. Теория электролитической диссоциации
- •Вещества (растворы) проводят электрический ток не проводят электролиты неэлектролиты
- •16. Массовая доля
- •17. Многообразие органических соединений
- •18. Классификация органических соединений
- •19. Углеводороды
- •20. Применение углеводородов
- •21. Природные источники ув - См печатные листы
- •22. Спирты
- •23. Карбоновые кислоты
- •24. Жиры
- •Применение жиров
- •25. Углеводы
- •26. Белки
Раздел 1.Строение вещества
Тема 1. 1. Строение атома. Псхэ.
1. Атом
Атомы - это частицы, из которых состоят молекулы.
Строение атома: в ядре находятся протоны (р+) и нейтроны (п0), вокруг ядра атома вращаются электроны (ē).
Изотопы - это разновидности атомов одного элемента с одинаковым зарядом ядра, но разной атомной массой (т.к. количество нейтронов у таких атомов различно).
НАПРИМЕР:
3517CL 3717CL - это изотопы хлора
35-17=18, 37-17=20.
Разница между массой атома и зарядом ядра есть количество нейтронов.
17, т.е. равны порядковому номеру в ПСХЭ.
Как считать:
п0= Ar - Z,
где Ar - это относительная атомная масса, Z - заряд ядра (равен порядковому номеру в ПСХЭ).
2. Строение атома
Атом от греч. – неделимый
Электрон от греч. - янтарь
1898 г. Дж. Томпсон – атом представлен как пудинг с изюмом.
1910 г. Э. Резерфорд – планетарная модель строения атома
n - номер периода,
Е - энергия,
2, 8,18, 32 - Максимальное количество электронов в соответствующих электронных слоях,
s, p, d, f - энергетические подуровни
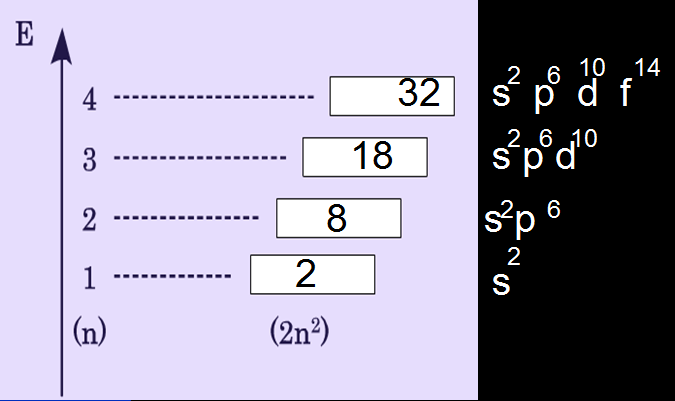
1s 2s 2p 3s 3p и т.д.
3. Периодическая система химических элементов (псхэ)
|
ПСХЭ |
|
|
Периоды -7 |
Группы - 8 |
|
1 малые 2 эл-та 2 8 элементов 3 |
главные и побочные |
|
4 большие 5 18 элементов 6 32 7 |
№ группы = число ē на последнем энергетическом уровне (валентность), высш. ст. ок. |
|
→увел. НеМе св-ва, число ē на внешн. энерг. уровне, Э.О. |
↓увел. Ме св-ва, радиус атома, умен. Э.О. |
План характеристики химического элемента
-
химический символ и название элемента; - Н , водород
-
атомный номер, номер периода и группы, вид подгруппы; - атомный номер - 1, номер периода - 1, номер группы - 1.
-
заряд и состав ядра атома; Z=1, p+=1, ē=1, n0 ≈ 0
-
электронная формула атома, электронное семейство; 1s1, s-семейство
-
свойства атомов элемента (металлические или неметаллические); Н- неметалл, но проявляет чаще всего восстановительные свойства.
-
формула высшего оксида и гидроксида. Н2О, КОН
4. Валентность и степень окисления
Значение валентности элемента совпадает с номером его группы, это число электронов на последнем энергетическом уровне.
Валентность - это число химических связей.
электронно-графическую формулу атома кислорода
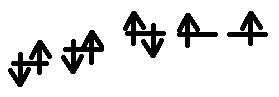
электронно-графическую формулу молекулы кислорода

Степень окисления - это количество принятых или отданных электронов.
Молекулы состоящие из одинаковых атомов называют простыми.
У сложных молекул ст. ок. вычисляется математически. Важно запомнить: Ме+№гр, Н+1, О-2, НеМе-№гр или недост. е, сумма всех ст. ок. в молекуле рана 0.
5. Химическая связь(ковалентная и ионная)
Химическая связь - это то, чем соединяются атомы между собой в различные молекулы, ионы, кристаллы.
Между ионами положительными и отрицательными (катионными и анионами, которые представлены в таблице растворимости) образуется ионная связь.
Например, NaCL = Na+ + CL-
Ковалентная связь – это связь с образованием общих электронных пар.
Н2 Н-Н Н(:) Н, Н-CL
ковалентная неполярная ковалентная полярная
одинаковые неметаллы разные неметаллы
