
- •Квантовые теории Введение
- •История появления понятия «кванта»
- •Понятие кванта
- •Фотоэффект
- •Корпускулярно-волновой дуализм
- •Квантовая механика Математический аппарат квантовой механики
- •Операторы координаты и импульса
- •Принцип неопределенности Гейзенберга
- •Стационарное уравнение Шредингера
- •Амплитуда вероятности
- •Волновой пакет
- •Тождественность электронов
- •Принцип Паули
- •Спектроскопические опыты и введения понятия квантового числа
- •Квантовая теория поля
- •Кванты – переносчики взаимодействия
- •Понятие вакуумного состояния. Минимальная энергия поля
- •Квантование поля
- •Квантовая электродинамика (кэд)
- •Диаграммы Фейнмана
- •Рассеяние электрона на электроне
- •Рассеяние фотона на электроне
- •Рассеяние фотона на фотоне
- •Квантовая хромодинамика
- •Поляризация вакуума
- •Слабое взаимодействие
- •Лекция 7 в поисках новых законов
Принцип Паули
Волновые функции системы тождественных частиц, обладающих полуцелыми спинами (электроны, протоны, нейтроны) являются антисимметричными. Волновые функции системы тождественных частиц с целыми спинами (фотоны, π-мезоны) являются симметричными. Частицы с полуцелыми спинами носят название фермионов, а частицы с целыми спинами – название бозонов. Частицы с полуцелыми спинами – электроны, протоны, нейтроны и др. являются частицами, из которых состоит вещество, частицы с целыми спинами, например, фотон, являются переносчиками взаимодействия. В соответствии со свойствами симметрии волновых функций при описании состояний частиц говорят о статистике Ферми-Дирака (для фермионов) или о статистике Бозе-Эйнштейна (для бозонов).
Принцип Паули формулируется для фермионов, этот принцип не является логически необходимым следствием квантовой механики, поэтому кратко рассмотрим причину его формулировки.
При изучении строения атома было отмечено, что существует насыщение энергетических уровней, то есть на каждом энергетическом уровне может находиться не больше определенного числа электронов. Чтобы объяснить этот факт, Паули предположил, что два электрона не могут находиться в строго тождественных состояниях. Таким образом, для частного случая квантовых систем – атомов или молекул – принцип Паули формулируется следующим образом: в атоме или молекуле два электрона никогда не находятся в одном и том же квантовом состоянии. То есть, если существование электрона в некотором квантовом состоянии запрещает появление еще одного электрона в этом же состоянии.
Принцип Паули действует только для фермионов. Для бозонов, волновая функция которых симметрична, одинаковые частицы симметричны в отношении занимаемых ими положений и "не мешают" друг другу занимать одинаковые физические состояния. Следовательно, бозоны могут находиться в одинаковых квантовых состояниях.
Значение принципа Паули в том, что он дал возможность объяснить насыщение энергетических уровней. Теперь чтобы узнать максимальное число электронов на данном уровне нужно посчитать число возможных состояний, которые соответствуют различным комбинациям квантовых чисел. Для описания состояния элементарных частиц, используют понятие квантового числа. Например, если электроны находятся в разных состояниях, то все наборы квантовых чисел, характеризующих состояние электрона в атоме, должны быть различными. Рассмотрим понятие квантового числа более подробно.
Спектроскопические опыты и введения понятия квантового числа
Согласно классической электродинамике, электрон должен непрерывно излучая терять энергию и очень скоро упасть на ядро. Однако атомы стабильны и излучают спектральные линии только строго определенной частоты.
Бор предположил, что в стационарных состояниях атом не излучает, а излучение возникает только когда электрон переходит с одного энергетического уровня на другой. Это позволило Бору объяснить распределение частот излучения атома водорода, но он не мог ничего сказать об интенсивности и поляризации излучения. Чтобы восполнить этот пробел Бор сформулировал принцип соответствия: результаты квантовой теории должны асимптотически стремиться к классическим в области больших квантовых чисел.
Бор предложил рассматривать фиктивный классический атом в котором электрон непрерывно испускает весь набор частот. Реальный атом в стационарном состоянии не излучает. Оказывается, что каждой частоте фиктивного атома соответствует определенный переход электрона с одного энергетического уровня на другой в квантовом атоме, приводящий к испусканию излучения той же частоты. То есть, в области больших значений квантовых чисел имеется хорошее соответствие между частотами излучения, испускаемого по классическим законам и частотам, которые может излучать в процессе квантового перехода электрон. Если классический фиктивный атом испускает все частоты непрерывно и одновременно, реальный атом может испускать при каждом отдельном акте излучения лишь одну из них.
Подтвердив одинаковость предсказаний классической и квантовой теорий в отношении частот, Бор допустил, что предсказания классической теории в отношении интенсивности и поляризации излучения фиктивных атомов будут справедливы и для реальных атомов (принцип соответствия). Таким образом, принцип соответствия позволил приближенно вычислять интенсивность линий атомных спектров.
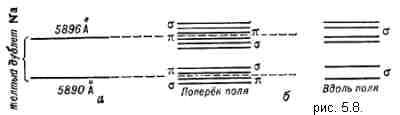
Но, несмотря на успехи квантовой механики, она не могла в то время объяснить все факты спектроскопии. В частности в спектрах атомов существовали «лишние» линии, происхождение которых не могли объяснить. Например, в 1896 г. Петер Зееман открыл, что основные спектральные линии расщеплялись в магнитном поле на несколько компонент, то есть имели «тонкую структуру» (эффект Зеемана, см. рис. 5.8. расщепление спектральных линий атома натрия в магнитном поле). Чтобы дать объяснение спектроскопическим явлениям ввели понятие квантовых чисел.
Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Для характеристики состояния электрона в атоме используют четыре квантовых числа.
-
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает положительные целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Если использовать для описания квантовых чисел понятия механики, то орбитальное или главное квантовое число является орбитальным моментом количества движения
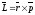 ,
где р – импульс, а r
– расстояние до ядра.
,
где р – импульс, а r
– расстояние до ядра. -
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1.
-
Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l до - l. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-орбиталей перпендикулярно ориентированных в пространстве: px, py, pz.
-
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и –1/2. Его открыли Гаудсмит и Уленбек, которые при анализе атомных спектров пришли к выводу, что помимо орбитального момента количества движения электрон в атоме обладает еще и собственным моментом
 =±½.
Это число соответствует двум возможным
ориентациям магнитного момента
электрона.
=±½.
Это число соответствует двум возможным
ориентациям магнитного момента
электрона.
Набор четырех значений квантовых чисел полностью характеризует состояние электрона в атоме. Согласно принципу запрета Паули для каждого набора квантовых чисел в атоме в фиксированный Момент времени существует не более одного электрона с соответствующим набором.
