
- •Передмова
- •ВСТУП
- •1. ТЕРЕЗИ І ЗВАЖУВАННЯ
- •1.2. Аналітичні терези АД-200
- •1.3. Аналітичні терези АДВ-200М і ВЛА-200М
- •1.4. Лабораторні аналітичні одноплечі терези
- •1.5. Експериментальна частина
- •1.5.3. Визначення еквівалента елемента
- •1.6. Запитання і задачі
- •1.7. Література
- •2. ТЕПЛОВІ ЕФЕКТИ ХІМІЧНОЇ РЕАКЦІЇ
- •2.1. Вступ
- •2.2. Експериментальна частина
- •2.2.1. Визначення теплоти нейтралізації
- •2.3. Запитання і задачі
- •2.4. Література
- •3. КОМПЛЕКСНІ СПОЛУКИ
- •3.1. Будова комплексних сполук
- •3.2. Номенклатура комплексних сполук
- •3.2.1 Комплексні сполуки - неелектроліти
- •3.2.2. Сполуки з комплексними катіонами
- •3.2.3. Сполуки з комплексними аніонами
- •3.3. Стійкість комплексних іонів
- •3.4. Експериментальна частина
- •3.4.1. Відмінність між простими і комплексними іонами заліза
- •3.4.2. Комплексні катіони
- •3.4.4. Дисоціація комплексних іонів
- •3.4.5. Комплексні аніони
- •3.4.5. Дисоціація подвійних солей
- •3.4.6. Утворення амінів міді
- •3.5. Запитання і задачі
- •3.6. Література
- •4. ВОДНЕВИЙ ПОКАЗНИК рН
- •4.1. Визначення кислотності
- •4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
- •4.3. Експериментальна частина
- •4.3.1. Вимірювання рН з допомогою індикаторів
- •4.3.2. Колориметричний метод визначення рН
- •4.4. Запитання і задачі
- •4.5. Література
- •5. БУФЕРНІ РОЗЧИНИ
- •5.1. Обчислення рН буферних розчинів, утворених слабкою кислотою та її сіллю
- •5.2. Обчислення рН буферних систем, утворених слабкими основами та їх солями
- •5.3. Експериментальна частина
- •5.3.1. Приготування буферних розчинів
- •5.3.2. Буферна дія
- •5.3.3. Вплив розбавлення на рН буферного розчину
- •5.3.4. Втрата буферної дії
- •5.4. Запитання і задачі
- •5.5. Література
- •6. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
- •6.1. Швидкість хімічних реакцій
- •6.2. Хімічна рівновага
- •6.3. Експериментальна частина
- •6.3.1. Вплив ступеня подрібнення (величини поверхні зіткнення речовин) на швидкість реакції в гетерогенній системі
- •6.3.2. Розчинення карбонату кальцію в соляній кислоті
- •6.3.3. Залежність швидкості реакції від концентрації
- •6.3.4. Вплив температури на швидкість реакції
- •6.3.5. Вплив концентрації реагуючих речовин на хімічну рівновагу
- •6.3.6. Оборотність зміщення хімічної рівноваги
- •6.3.7. Вплив температури на хімічну рівновагу (груповий дослід)
- •6.4. Запитання і задачі
- •6.5. Література
- •7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
- •7.2. Елементи ІА-підгрупи (водень, натрій, калій)
- •7.3. Елементи ІІА-підгрупи (магній і кальцій)
- •7.4. Експериментальна частина
- •7.4.1. Одержання водню
- •7.4.2. Окислювальні і відновлювальні властивості пероксиду водню
- •7.4.3. Реакції катіона натрію
- •7.4.4. Реакція катіона калію
- •7.4.5. Реакції катіона магнію
- •7.4.6. Реакції катіона кальцію
- •7.5. Запитання і задачі
- •7.6. Література
- •8.2. Елементи ІІІА-підгруш (бор і алюміній)
- •8.3. Елементи ІVА-підгруп (вуглець і кремній)
- •8.4. Елементи VА-підгрупи (азот і фосфор)
- •8.6. Елементи VІА-підгрупи (кисень і сірка)
- •8.7. Елементи VІІА-групи (галогени)
- •8.8.2. Гідроліз бури
- •8.8.3. Якісний аналіз бору
- •8.8.4. Дія лугів і кислот на алюміній (під тягою)
- •8.8.8. Відновлювальні властивості вугілля
- •8.8.9. Гідроліз солей вугільної кислоти
- •8.8.10. Одержання і властивості кремнію
- •8.8.11. Одержання і властивості аміаку
- •8.8.12. Одержання і властивості кальцієвих солей ортофосфорної кислоти
- •8.8.14. Одержання кисню і вплив каталізатора на швидкість розкладу KСlO3
- •8.8.16. Реакція хлорид-іона
- •9.2. Біологічна роль деяких важливих d-елементів
- •9.2.1. Реакції катіона марганцю з лугами (NаОН і KOH)
- •9.2.2. Реакції катіона цинку
- •9.2.3. Реакції катіона кобальту
- •9.2.4. Реакції катіонів срібла
- •9.2.5. Реакції катіонів свинцю
- •9.2.6. Реакції катіонів ртуті (І)
- •9.2.7. Реакції катіонів міді
- •9.3. Література
72
кальцію (~0,05 г). Додайте до нього 5-6 мл 1н розчину щавлевої кислоти і нагрійте суміш до кипіння. Потім додайте 2-3 краплі метилового оранжево-го, повільно нейтралізуйте рідину гідроксидом амонію до переходу черво-ного забарвлення індикатора в жовте. Вмісту склянки дайте постояти доти, поки осад оксалату кальцію збереться на дні. Після цього профільтруйте про-зорий розчин через фільтр "синя стрічка", 2-3 рази промийте осад у склянці холодною водою шляхом декантації, перенесіть його на фільтр, 1-2 рази спо-лосніть дно склянки і її стінки водою. На фільтрі осад промийте 5-6 разів не-великими порціями холодної води.
Потім нахиліть лійку над склянкою, в якій проводилось осадження, і змийте в неї основну частину осаду. Встановіть лійку в штативі і декілька разів пропустіть через фільтр по 5-6 мл гарячої розведеної (1:5) сірчаної кислоти. Фільтрат збирайте в ту ж склянку з осадом. Вміст склянки добре перемішайте і нагрівайте до повного розкладу оксалату кальцію.
Гарячу рідину титруйте розчином перманганату калію до появи слабкого малинового забарвлення, яке не зникає протягом 1-2 хв. (так само, як і при встановленні нормальної концентрації розчину перманганату калію за щавлевою кислотою). Масу Са2+ в досліджуваному розчині обчислити за формулою:
|
m = NKMnO4 VKMnO4 0,001 ECa , |
|
де NKMnO |
– нормальна концентрація розчину KMnO4; VKMnO |
– його об'єм; |
4 |
|
4 |
E – еквівалентна маса Са2+ .
Якщо на титрування виділеної щавлевої кислоти пішло 22,75 мл 0,05181н розчину перманганату калію, то одержимо:
mCa = 0,05181 22,75 0,001 20,04 = 0,02362 г.
Іноді це визначення виконують інакше. Осаджують Са2+ відміреним об'є- мом розчину оксалату амонію вапняної концентрації. Решту іонів C2O42- відтитровують перманганатом. Потім знаходять масу (NH4)2 C2O4, що прореагувала з Са2+ , а за нею – і масу самого кальцію. Однак цей метод менш точний.
Перманганатометрію широко використовують для визначення Са2+ у витяжках із біологічних матеріалів, для визначення вмісту водорозчинних сполук кальцію в грунті.
7.5.Запитання і задачі
1.Вкажіть всі відомі лабораторні й промислові способи одержання водню.
2.Чому полум'я водню невидиме?
3.Який об'єм водню за нормальних умов можна одержати з 1 г води?
4.Визначити окислювач і відновлювач та підібрати коефіцієнти в таких реакціях окислення-відновлення:
а) H2O2 + KJ + HCl → J2 + KCl + H2O;
73
б) CrCl3 + H2O2 + NaOH → Na2CrO4 + NaCl + H2O.
5.Закінчити рівняння окислювально-відновлювальних реакцій:
a) MnSO4 + H2O2 + KOH → б) FeSO4 + H2O2 + H2SO4 →
6.Охарактеризуйте фізичні та хімічні властивості металів.
7.Як змінюються відновлювальні властивості в атомів металів головних підгруп періодичної системи зі зростанням порядкового номера ?
8.Від чого залежать хімічні властивості металів ?
9.Обчисліть процентний вміст оксиду калію в карналіті, хлориді калію, нітраті калію.
10.Як треба зберігати калій і натрій в лабораторних умовах?
11.Чи можна отримати металічний калій при електролізі водного розчину хлориду калію ? Чому ?
12.Подайте формули солей найважливіших калійних добрив.
13.Чому їдкі дуги необхідно зберігати в добре закритому посуді?
14.Розрахуйте нормальність 1%-ного розчину КОН, якщо густина розчину дорівнює 1000 кг/м3 .
15.Подайте електронні формули атома магнію і кальцію.
16.Як змінюються основні властивості гідроксидів елементів головної
підгрупи другої групи періодичної системи ? Чим це можна пояснити ?
17.Чому карбонати кальцію і магнію розчиняються в природній воді ? Складіть рівняння відповідних реакцій.
18.Що береться за одиницю виміру твердості води ?
20.На титрування 100 мл води в присутності метилового оранжевого витрачено 3,4 мл 0,0088 н розчину сірчаної кислоти. Обчисліть твердість води в мекв/л.
21.Складіть рівняння реакції, що відбувається при твердінні гашеного вапна.
22.Як отримують негашене вапно? В чому полягає процес гасіння вапна? Виразіть реакції, що відбуваються при цьому, рівняннями.
23.Чому не можна осадити повністю гідроксид магнію дією гідроксиду амонію?
24.Складіть рівняння таких реакцій:
Mg + H3PO4 →
Mg + H2SO4 (конц.) →
Mg + H2SO4 (розв.) →
Mg + HNO3 (конц.) →
7.6.Література
1.Платонов Ф.Н., Дейкова З.Е. Практикум по неорганической химии: Учеб.пособие для с.-х. и биолог. специальностей вузов. – 3-е изд. –
М.: Высш.шк., 1985. – 255 с.
74
2.Неорганическая химия: Метод. указ. к лекциям для студентов 1 курса // Сост.: Л.А.Фролова, Н.А.Князев, С.А.Рогожина и др. – М., 1979. - 172 с.
3.Цитович И.К. Курс аналитической химии: Учебник для с.-х.вузов. –
М.: Высш.шк., 1985. – 400 с.
4.Хомченко Г.П., Цитович И.К. Неорганическая химия: Учебник для с.-х. вузов. – М.: Высш.шк., 1987. – 464 с.
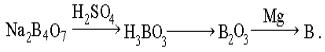
75
8.ВЛАСТИВОСТІ Р-ЕЛЕМЕНТІВ
8.1.Загальна характеристика р-елементів
Відомо, що у р-елементів заповнюється електронами р-підрівень зовнішнього електронногорівня, наякомуможутьперебувативідодногодошестиелектро-нів.
У періодичній системі 30 р-елементів. Ці р-елементи або їхні р-електронні аналоги утворюють підгрупи ІІІА, ІVА, VА, VIА, VIIА, VIIIA. Будова зовніш-нього
електронного рівня атомів елементів цих підгруп розвивається таким чи-ном: nsp1, ns2p2, ns2p3, ns2p4, ns2p5 і ns2p6.
У цілому у р-елементів, крім алюмінію, відновлювальна активність вираже-на порівняно слабо. Навпаки, при переході від ІІІА до VІIА-підгрупи спостері-гається посилення окислювальної активності нейтральних атомів, ростуть вели-чини спорідненості до електрона та енергії іонізації, збільшується електронегативність р-елементів.
В атомах р-елементів валентні не тільки р-електрони, а й електрони зовнішнього рівня. Вищий позитивний ступінь окислення р-електронних аналогів дорівнює номеру групи, в якій вони перебувають.
Найбільше значення для сільського господарства мають сполуки елементів VАпідгрупи (азоту, фосфору, миш'яку), а також елементів IIІА-підгруп (бору) та VІІА-підгрупи (фтору і хлору).
Елементарні речовини і сполука деяких р-елементів мають велике значення для нової техніки. Наприклад, елементи ІVА-підгрупи кремнію і германію – напівпровідники; широкозастосовуєтьсявпромисловості алмаз (табл. 8.1).
8.2. Елементи ІІІА-підгруш (бор і алюміній)
Бор B (1s22s22p1) – типовий неметал. Високої чистоти бор одержують термічнимрозкладомбороводнівігалідівбору.
Бор – досить поширений елемент. Вміст його в земній корі становить 3 10-4 мас.%, що у 5 разів більше свинцю, і в 250 разів більше срібла. Однак, бор є розсіяним елементом. У природі бор зустрічається у вигляді сполук; най-більш важливими з них є бура Na2B4O7 10H2O і борна кислота H3BO3 (остання – у воді гарячих джерел). У вільному стані бор отримують за декілька стадій: спершу борну кислоту нагріванням переводять у сескві-оксид бору B2O3, з якого потім відновлюютьбормагніємабонатрієм:
B2O3 + 3Mg → 3MgO + 2B.
В результаті виходить аморфний бор. Із бури отримують за схемою:
Бор розчиняється лиже у концентрованій азотній та сірчаній кислотах:
В+ 3HNO3 →Na3BO3 + 3NO2, 2B + 3H2SO4 →2H3BO3 + 5SO2.
При високих температурах він стає активним і взаємодіє з киснем (при 1000 К),
76
Таблиця 8.1. Властивості елементів
Показники |
B |
C |
N |
O |
F |
Al |
Si |
P |
S |
Cl |
Br |
|||
Порядковий |
номер |
5 |
6 |
7 |
8 |
9 |
13 |
14 |
15 |
16 |
17 |
35 |
||
Відносна атомна маса, а.о.м. |
10,810 |
12,011 |
14,007 |
15,999 |
18,988 |
29,982 |
28,085 |
30,974 |
32,064 |
35,453 |
79,909 |
|||
Валентні електрони |
2s12p1 |
2s22p2 |
2s22p3 |
2s22p4 |
2s22p5 |
3s23p1 |
3s23p2 |
3s23p3 |
3s23p4 |
3s23p5 |
4s24p5 |
|||
Металічний радіус атома, нм |
0,091 |
- |
0,071 |
- |
- |
0,143 |
0,134 |
0,130 |
- |
- |
- |
|||
Ковалентний радіус атома, нм |
0,088 |
0,077 |
0,077 |
0,073 |
0,071 |
0,126 |
0,117 |
0,110 |
0,104 |
0,099 |
0,114 |
|||
Радіус іона |
E |
3+, |
нм |
0,020 |
- |
- |
- |
- |
0,057 |
- |
- |
- |
- |
- |
Радіус іона |
E |
4+, |
нм |
- |
- |
- |
- |
- |
- |
0,034 |
- |
- |
- |
- |
Радіус іона |
E |
5+, |
нм |
- |
- |
0,015 |
- |
- |
- |
- |
0,035 |
- |
- |
- |
Радіус іона |
E |
6+, |
нм |
- |
- |
- |
- |
- |
- |
- |
- |
(0,029) |
- |
- |
Радіус іона |
E |
7+, |
нм |
- |
- |
- |
- |
- |
- |
- |
- |
- |
0,026 |
0,039 |
Радіус іона |
E |
1-, |
нм |
- |
- |
- |
- |
0,133 |
- |
- |
- |
- |
0,181 |
0,195 |
Радіус іона |
E |
2-, |
нм |
- |
- |
- |
0,136 |
- |
- |
- |
- |
0,182 |
- |
- |
Радіус іона |
E |
3-, |
нм |
- |
- |
0,148 |
- |
- |
- |
- |
0,186 |
- |
- |
- |
Енергія іонізації |
EО→ E+, еВ |
8,30 |
11,26 |
14,53 |
- |
17,42 |
5,99 |
8,15 |
10,48 |
- |
12,97 |
11,84 |
||
Спорідненість до електрона, еВ |
- |
- |
- |
1,47 |
3,60 |
- |
- |
- |
2,08 |
3,80 |
3,54 |
|||
Відносна електронегативність |
2,01 |
2,50 |
3,07 |
3,50 |
4,10 |
1,47 |
1,74 |
2,10 |
2,50 |
2,83 |
2,74 |
|||
Густина, г/см 3 |
|
|
2,34 |
3,52 |
1,026 |
1,13 |
1,11 |
2,70 |
2,42 |
1,83 |
2,07 |
1,56 |
3,12 |
|
|
|
|
|
|
(алмаз) |
(рідина) |
(рідина) |
(рідина) |
|
(крист.) |
(білий) |
(ромб.) |
(рідина) |
(рідина) |
Температура плавлення, ОС |
2075 |
3750(графіт |
-209,9 |
-218,8 |
-220 |
660 |
1415 |
44,10 |
112,8 |
-101 |
-7 |
|||
Температура кипіння, ОС |
3700 |
- |
-195,8 |
-183 |
-188 |
2520 |
3250 |
275 |
444,6 |
-35 |
59 |
|||
77
утворюючиоксид боруВ2O3, якийназивається борним ангідридом: 4В + 3O2 → 2В2O3. Останній являє собою безколірну рідину – скловидну масу, яка розчиняється у воді з утвореннямборноїкислоти:
В2O3 + 3H2O ↔2Н3В03.
Борна кислота – це дрібні білі кристалики, розчинні в теплій воді. За своєю силою вона слабкіша вугільної: Kдис.H3 BO3 – 5 10-10; Kдис.H2 CO3 –4 10-7, але
більш стійка. Ступінь дисоціації борної кислоти в 0,1 н розчині складає 0,001%. При нагріванні борна кислота поступово зневоднюється, спершу утворюючи метаборну кислоту Н2В4О7 і, нарешті, оксид бору В2O3. Хімізм усіх термічних перетворень може бути представлений рівняннями:
Н3ВО3 → HBO2 + H2O
4HBO2 → H2B4O7 + H2O
H2 B4 O7 t →2B2 O3 + H2 O.
Усі вказані реакції зворотні і протікають у зворотному напрямі при пониженні температури.
Солі борної кислоти. Солі борної кислоти називають боратами, солі тетраборної кислоти – тетраборатами. Солі одержують дією на кислоту лугом за рівнянням:
4Н3ВО3 + 2NaOH → Na2B4O7 + 7H2O.
Характерно, що при реакції нейтралізації борної кислоти виходять не борати, а тетраборати. В даному випадку отримується тетраборат натрію (бура), який застосовують у виробництві емалей (при виготовленні посуду) та легкоплавкої поливи (нею покривають фарфоровий і фаянсовий посуд), а також для виготовлення лампового і оптичного скла.
Буру широко використовують при паянні і для зварювання металів, бо, сплавляючись з оксидами металів, утворює метаборати, що полегшує змочування металу припоєм. Якщо сплавляти, наприклад, СоО2 з бурою, то виходить синє ("кобальтове") скло:
СоО2 + Nа2В4O7 → Со(ВO2)2 2NаВO2.
Сполуки хрому при сплавленні з бурою утворюють смарагдово-зелене скло. Цими процесами користуються для якісного виявлення Co, Сr та інших елементів у сполуках.
Характерними властивостями тетраборатів є те, що при дії на них сильною кислотою утворюється не тетраборна, а звичайна борна кислота:
Nа2В4O7 + H2SO4 + 5H2O → Na2SO4 + 4H3BO3.
Борну кислоту використовують у скляній і керамічній промисловості для виробництва різних сортів оптичного і жаростійкого скла, емалей, полив. Емалі
– це легкоплавкі, білі чи забарвлені силікатні покриття, що являють собою тонкі шари, утворені на поверхні виробів (головним чином, металевих) розплавленням різних оксидів і закріплені випалом. До складу емалей входять: польовий шпат (K2O Al2O3 6SiO2), пісок або кварц (SiO2), сода
78
(Na2CO3), бура чи борна кислота, селітра (КNO3) та інші компоненти, а також при потребі різні кольорові оксидидля надання емалям будь-якого кольору.
Емалеві покриття відзначаються доброю механічною стійкістю, протистоять корозійним впливам, красиві на вигляд і широко застосовуються для покриття металевого посуду, хімічної апаратури, побутових холодильників та інших предметів.
Бор є важливим мікроелементом, що сприяє обміну речовин. В організмі тварин і людини бор знаходиться в печінці, нирках, ендокринних залозах, посилює обмінні процеси, сприяє нагромадженню вітаміну А.Особливе значення має бор для нормального розвитку рослин. Бор поліпшує постачання рослин і, в першу чергу, їхньої кореневої системи киснем. Пояснюється це тим, що бор утворює з багатьма органічними сполуками (спиртами, оксикислотами, цукрами тощо) органічні пероксиди, а ті й постачають корінню необхідний йому кисень, при нестачі його не ростуть корені, уповільнюється ріст рослин, припиняються цвітіння та утворення плодів. Повна відсутність бору в грунті призводить до загибелі рослин.
Внесення сполук бору в грунт виявилося вельми ефективним засобом для підняття урожайності багатьох культур, тому широко розповсюджені борні мікродобрива, які містять борну кислоту H3BO3, буру Na2B4O7; і борат магнію Mg3(ВО3)2. При внесенні 0,5-1 кг борних добрив на 1 га урожайність цукрових буряків збільшується на 25-35 ц/га, а цукристість коренів – на 0,5-1,5 %. Доза
внесення добрива – 10 г/га В. |
|
|
|
Алюміній |
Al (1s22s22р63s1). |
Основним |
методом отримання алюмінію |
є електроліз |
розплаву Аl2O3, |
в кріоліті |
Na3[AlF6] при температурах |
950-1000°С. Алюміній – активний метал з великою спорідненістю з киснем: на повітрі він швидко покривається дуже тонкою (0,00001 мм), проте дуже щільною плівкою оксиду, яка захищає метал від подальшого окислення.
В ряду напружень алюміній розташований лівіше водню. Коли з металу видалити оксидну плівку, то він розкладає воду:
2A1 + 6H2O → 2Аl(ОН)3 + ЗН2O.
Розбавлену кислоту азотну він відновлює в залежності від концентрації та температури до NO, N2O, N2. В концентрованих азотній та сірчаній кислотах він не розчиняється, бо утворений Al2O3 не взаємодіє з концентрованими кислотами-окис- лювачами. Розчиняєтьсяврозчинахлугівзутвореннямгідроксоаквакомплексу:
2A1 + 2NаОH + 10H2O → 2Na[Al(OH)4(H2O)2] + 3H2.
Оксид алюмінію Аl2O3, білого кольору, вельми тугоплавкий, з дуже високою твердістю, нерозчинний у воді. В лабораторії його отримують спалюванням алюмінію в кисні:
4А1 + 3O2 → 2Аl2O3, Н298 = 1685 кДж/моль.
В промисловості Аl2O3, одержують із бокситів або нефелінів. Оксид алюмінію амфотерний; взаємодієізкислотами:
A12O3 + 6HCl + 3Н2О → Аl(Н2О)6С13,
із лугами: Аl2O3+ 2KOH → 2КАlO2 (при сплавленні).
