
- •Передмова
- •ВСТУП
- •1. ТЕРЕЗИ І ЗВАЖУВАННЯ
- •1.2. Аналітичні терези АД-200
- •1.3. Аналітичні терези АДВ-200М і ВЛА-200М
- •1.4. Лабораторні аналітичні одноплечі терези
- •1.5. Експериментальна частина
- •1.5.3. Визначення еквівалента елемента
- •1.6. Запитання і задачі
- •1.7. Література
- •2. ТЕПЛОВІ ЕФЕКТИ ХІМІЧНОЇ РЕАКЦІЇ
- •2.1. Вступ
- •2.2. Експериментальна частина
- •2.2.1. Визначення теплоти нейтралізації
- •2.3. Запитання і задачі
- •2.4. Література
- •3. КОМПЛЕКСНІ СПОЛУКИ
- •3.1. Будова комплексних сполук
- •3.2. Номенклатура комплексних сполук
- •3.2.1 Комплексні сполуки - неелектроліти
- •3.2.2. Сполуки з комплексними катіонами
- •3.2.3. Сполуки з комплексними аніонами
- •3.3. Стійкість комплексних іонів
- •3.4. Експериментальна частина
- •3.4.1. Відмінність між простими і комплексними іонами заліза
- •3.4.2. Комплексні катіони
- •3.4.4. Дисоціація комплексних іонів
- •3.4.5. Комплексні аніони
- •3.4.5. Дисоціація подвійних солей
- •3.4.6. Утворення амінів міді
- •3.5. Запитання і задачі
- •3.6. Література
- •4. ВОДНЕВИЙ ПОКАЗНИК рН
- •4.1. Визначення кислотності
- •4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
- •4.3. Експериментальна частина
- •4.3.1. Вимірювання рН з допомогою індикаторів
- •4.3.2. Колориметричний метод визначення рН
- •4.4. Запитання і задачі
- •4.5. Література
- •5. БУФЕРНІ РОЗЧИНИ
- •5.1. Обчислення рН буферних розчинів, утворених слабкою кислотою та її сіллю
- •5.2. Обчислення рН буферних систем, утворених слабкими основами та їх солями
- •5.3. Експериментальна частина
- •5.3.1. Приготування буферних розчинів
- •5.3.2. Буферна дія
- •5.3.3. Вплив розбавлення на рН буферного розчину
- •5.3.4. Втрата буферної дії
- •5.4. Запитання і задачі
- •5.5. Література
- •6. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
- •6.1. Швидкість хімічних реакцій
- •6.2. Хімічна рівновага
- •6.3. Експериментальна частина
- •6.3.1. Вплив ступеня подрібнення (величини поверхні зіткнення речовин) на швидкість реакції в гетерогенній системі
- •6.3.2. Розчинення карбонату кальцію в соляній кислоті
- •6.3.3. Залежність швидкості реакції від концентрації
- •6.3.4. Вплив температури на швидкість реакції
- •6.3.5. Вплив концентрації реагуючих речовин на хімічну рівновагу
- •6.3.6. Оборотність зміщення хімічної рівноваги
- •6.3.7. Вплив температури на хімічну рівновагу (груповий дослід)
- •6.4. Запитання і задачі
- •6.5. Література
- •7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
- •7.2. Елементи ІА-підгрупи (водень, натрій, калій)
- •7.3. Елементи ІІА-підгрупи (магній і кальцій)
- •7.4. Експериментальна частина
- •7.4.1. Одержання водню
- •7.4.2. Окислювальні і відновлювальні властивості пероксиду водню
- •7.4.3. Реакції катіона натрію
- •7.4.4. Реакція катіона калію
- •7.4.5. Реакції катіона магнію
- •7.4.6. Реакції катіона кальцію
- •7.5. Запитання і задачі
- •7.6. Література
- •8.2. Елементи ІІІА-підгруш (бор і алюміній)
- •8.3. Елементи ІVА-підгруп (вуглець і кремній)
- •8.4. Елементи VА-підгрупи (азот і фосфор)
- •8.6. Елементи VІА-підгрупи (кисень і сірка)
- •8.7. Елементи VІІА-групи (галогени)
- •8.8.2. Гідроліз бури
- •8.8.3. Якісний аналіз бору
- •8.8.4. Дія лугів і кислот на алюміній (під тягою)
- •8.8.8. Відновлювальні властивості вугілля
- •8.8.9. Гідроліз солей вугільної кислоти
- •8.8.10. Одержання і властивості кремнію
- •8.8.11. Одержання і властивості аміаку
- •8.8.12. Одержання і властивості кальцієвих солей ортофосфорної кислоти
- •8.8.14. Одержання кисню і вплив каталізатора на швидкість розкладу KСlO3
- •8.8.16. Реакція хлорид-іона
- •9.2. Біологічна роль деяких важливих d-елементів
- •9.2.1. Реакції катіона марганцю з лугами (NаОН і KOH)
- •9.2.2. Реакції катіона цинку
- •9.2.3. Реакції катіона кобальту
- •9.2.4. Реакції катіонів срібла
- •9.2.5. Реакції катіонів свинцю
- •9.2.6. Реакції катіонів ртуті (І)
- •9.2.7. Реакції катіонів міді
- •9.3. Література
62
7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
7.1.Загальна характеристика s-елементів
Ватомах s-елементів заповнюється електронами s-підрівень зовнішнього рівня. При цьому на s-підрівні можуть знаходитися один чи два електрони (при наявності на передостанньому рівні двох або восьми електронів).
Уперіодичній системі всього 14 s-елементів (включаючи водень і
гелій).
Атоми елементів ІА-підгрупи мають на зовнішньому електронному рівні по одному s-електрону (ns1), а атоми електронів ІІА-підгрупи – по два s-елек- трони (ns2). S-елементи обох підгруп мають схожі властивості. У вільному стані вони – типові метали з високою хімічною активністю, сильні відновлювачі. У цих елементів валентними є винятково s-електрони. Атоми цих елементів не бувають акцепторами електронів, а навпаки, тільки донорами і виявляють лише позитивні ступені окислення (відповідно +1 і +2).
До ІА-підгрупи належать s-елементи: літій, натрій, калій, рубідій, цезій і францій, які називаються лужними металами, бо гідриксиди деяких з них
здавна відомі як луги. Лужні метали мають на зовнішньому електронному рівні атома по одному електрону (s1), сильно віддаленому від ядра, відзначаються низькими потенціалами іонізації (табл. 7.1).
Таблиця 7.1. Властивості s-елементів
Показники |
H |
Na |
K |
Mg |
Ca |
Порядковий номер |
1 |
11 |
19 |
12 |
20 |
Відносна атомна маса, а.о.м. |
1,00797 |
22,99 |
39,1 |
24,31 |
40,08 |
Валентні електрони |
1s1 |
2s1 |
3s1 |
4s2 |
5s2 |
Ковалентний радіус атома, нм |
0,046 |
0,189 |
0,236 |
0,160 |
0,197 |
Радіус іона Н+, Е+, нм |
0,136 |
0,098 |
0,133 |
0,074 |
0,104 |
Енергія іонізації Е° → Е+; |
13,6 |
5,14 |
4,34 |
7,65 |
6,11 |
H°→ H+; E+→ Е2+, eB |
|
|
|
|
|
Відносна електронегативність |
2,1 |
0,93 |
0,82 |
1,31 |
1 |
Густина, г/см3 |
– |
0,968 |
0,862 |
1,740 |
1,54 |
Температура плавления, °С |
-259,1 |
97,8 |
63,6 |
651 |
851 |
Температура кипіння, °С |
-252,6 |
882,9 |
760 |
1107 |
1492 |
Стандартний електродний |
– |
-2,71 |
-2,92 |
-2,36 |
-2,81 |
потенціал Е° → Е+ + е- |
|
|
|
|
|
Е° → Е2+ + 2е-, еВ |
|
|
|
|
|
Атоми їх легко віддають електрон, виявляючи ступінь окислення +1. Це найактивніші метали, відновлювальні властивості виражені у них особливо різко і посилюються зі збільшенням порядкового номера елемента.
63
ІІА-підгрупа періодичної системи об'єднує s-елементн: берилій, магній, кальцій, стронцій, барій і радій. За винятком берилію, все це – поліізотопні елементи. Випромінювання ізотопа 9038 Sr , що виникає при ядерних вибухах,
надзвичайно небезпечне, бо викликає променеву хворобу, лейкоз крові, саркому кісток.
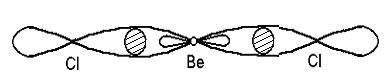
Атоми ІІА-підгрупи мають на зовнішньому електронному рівні по два електрони (s2) з протилежними спінами. При затраті необхідної енергії один із електронів s-стану переходить у р-стан, тобто обидва електрони стають неспареними. Тому елементи ІІА-підгрупи виявляють ступінь окислення +2. При утворенні молекул ЕХ2 відбувається гібридизація s- і р-електронних хмар атома Е, утворюються молекули лінійної будови Х-Е-Х, дипольний момент яких дорівнює нулю (як, наприклад, у хлориду берилію BeCl2,
див. рис. 7.1).
Рис. 7.1. Лінійна молекула BeCl2
Магній, кальцій, стронцій, барій і радій, які входять до ІІА-підгрупи, називають лужно-земельними металами, оскільки гідроксиди їх мають лужні властивості, а оксиди схожі із оксидами алюмінію і важких металів (так званих "земель").
Берилій (і частково магній) істотно відрізняється від решти елементів ІІАпідгрупи, тобто від типових лужно-земельних металів. Низкою власти-востей берилій схожий на алюміній, а магній – на цинк.
7.2. Елементи ІА-підгрупи (водень, натрій, калій)
Водень. Водень Н (1s1) займає перше місце в періодичній системі елементів Д.І.Менделєєва. Атомна маса його 1,008 у.о.м. Радіус атома 10-8 см. Він має найпростішу будову: єдиний електрон знаходиться безпосередньо у сфері дії атомного ядра.
Водень одержують різними методами. Вони базуютьмся на такій реакції:
2Н+ + 2е → H2.
Головне джерело отримання водню – вода. Одержують водень також із кислот, основ і метану.
Молекула водню Н2 відрізняється великою міцністю. Щоб розкласти 1 моль молекул водню на атоми, необхідно затратити 433,4 кДж. Цим пояснюється порівняно невелика активність молекулярного водню при звичайній температурі. Підвищену реакційну здатність має атомарний водень. Він утворюється в момент виділення із сполук.
Робота з воднем потребує обережності. Водень горючий і в суміші з кис-
64
нем або повітрям утворює вибухову суміш. При досліді з воднем не можна запалювати водень, який виходить із приладу, попередньо не переконавшись у його чистоті. Для цього заповнюють пробірку воднем із приладу, а потім у пробірці підпалюють водень від пальника. Якщо водень горить спокійно, то
цим же палаючим воднем підпалюють водень, що йде із приладу.
Калій. (1s12s22p63s23p64s1) – елемент ІА-підгрупи періодичної системи елементів Д.І. Менделєєва.
У промисловості калій, як і інші лужні метали, одержують електролізом розплавлених гідроксидів або розплавлених хлоридів. Крім того, калій отримують дією металічного натрію на розплавлений гідроксид калію:
КОН + Nа → NaOH + К.
Хімічно калій дуже активний, на повітрі швидко окислюється. При внесенні летких солей калію в полум'я газового пальника полум'я забарвлюється у фіолетовий колір.
Цей елемент забезпечує для рослин перебіг такого важливого процесу, як фотосинтез, він активізує діяльність багатьох ферментів, підвищує гідрофільність колоїдів протоплазми. Оптимальне забезпечення рослин калієм підвищує осмотичний тиск у клітинному сокові, що сприяє зимостійкості рослин. Раціональне калійне живлення призводить до підвищення у рослин стійкості до збудників грибкових та бактеріальних захворювань.
Значна частина калію знаходиться в клітинному соку рослин, частина його адсорбується колоїдами, решта калію нообмінно утримується митохондріями в протоплазмі.
Сполуки калію – необхідна складова частина клітини тваринних організмів і людини. Калій необхідний для нормальної роботи м'язових клітин і нервової системи. Іони калію разом з іонами натрію беруть участь у проведенні нервового імпульсу за системою нейронів. Нормальний ритм роботи організму, зокрема ритм скорочення серця, підтримується при певному співвідношенні концентрацій іонів калію і натрію.
Калій впливає на роботу органів шкірного дотику, є важливим стимулятором росту.
В організмі людини міститься близько 3 10-6 г радіоактивного ізотопу калію К40, і його наявності людина завдячує невеликій постійній радіоактивності свого тіла – 5 103 розпадів атомів калію за секунду. До цього рівня активності організми в ході біологічної еволюції пристосувалися, і він став необхідним фактором нормальної життєдіяльності.
Натрій (1s12s22p63s1), як і калій, входить до складу багатьох мінералів і гірських порід. Більшість солей натрію добре розчиняється у воді. На відміну від солей калію, чимало солей натрію утворюють кристалогідрати:
Na2CO3 10 Н2О, Na2SO4 10 Н2О, Na2S2O3 5 Н2О та ін. Усі солі натрію забарвлюють полум'я газового пальника у жовтий колір.
